1.Вычисления с использованием понятий «моль, мольная масса»
Пример 1. Вычислите массу серной кислоты, взятую количеством вещества 0,25 моль.
Решение:  ,
,  .
.

где m – масса вещества;
n – количество вещества (моль):
М – молярная масса.
 =98 г/моль×0,25 моль = 24,5 г
=98 г/моль×0,25 моль = 24,5 г
Пример 2. Вычислите количество вещества цинка в образце массой 2,6 г.
Решение: Относительная атомная масса (Аг) цинка равна 65, следовательно молярная масса цинка равна 65 г/моль, т.е М(Zn) = 65 г/моль. Вычисляем количество вещества цинка в образце по формуле:
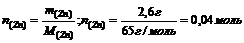
Пример 3. Вычислите массу иодида натрия NaJ, если количество вещества его равно 0,02 моль.
Решение: 1.Рассчитываем относительную молекулярную массу иодида натрия
Mr(NaJ) = Ar(Na) + Ar(J); Mr(NaJ) = 23 + 127 = 150
Молярная масса иодида натрия М(NaJ) = 150 г/моль.
2. Определяем массу иодида натрия по формуле:
m(NaJ) = n(NaJ)×M(NaJ); m(NaJ) = 0,02 моль×150 г/моль = 3 г
Законы химии
Закон сохранения массы.
Масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции.
Закон сохранения энергии.
Энергия системы, включающей вещества, вступивших в реакцию, равна энергии системы, включающей вещества, образовавшиеся в результате реакции.
Следствием закона сохранения энергии является открытый А. Лавуазье принцип, в соответствии с которым тепловые эффекты прямого и обратного процессов равны по абсолютной величине, но противоположны по направлению.
Закон кратных отношений был сформулирован английским ученым Дальтоном (1808 г):
Если два элемента образуют несколько химических соединений, то на одно и то же количество одного из них приходятся такие количества другого, которые относятся друг к другу как небольшие целые числа.
| N2O | NO | N2O3 | NO2 | N2O5 | |
| Количество весовых частей азота | |||||
| Количество весовых частей кислорода | 0,57
| 1,14

| 1,71

| 2,28

| 2,85

|
| Отношение между количествами кислорода в оксидах | 0,57:1,14: 1,71:2,28:2,85 = 1:2:3:4:5 |
Закон постоянства состава был сформулирован французским ученым Прустом (1808г).
Каким бы путем ни было получено данное химическое соединение, количественный состав его всегда останется одним и тем же.
Действительно, как бы, например, ни получалась вода при горении ли водорода в кислороде: 2Н2 + О2 = 2Н2О или разложении Са(ОН)2: Са(ОН)2  СаО + Н2О и т.д. отношение массы водорода и кислорода в ней всегда остается равным» 1: 8.
СаО + Н2О и т.д. отношение массы водорода и кислорода в ней всегда остается равным» 1: 8.
Из закона постоянства состава следует, что элементы соединяются друг с другом в строго определенных весовых отношениях. Поэтому вместе с установлением этого закона в химию было введено понятие эквивалента элемента.
Понятие об эквиваленте. Закон эквивалентов.
Эквивалент (Э) – это такое количество вещества, которое соединяется с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Один моль эквивалентов содержит столько эквивалентов, сколько атомов содержится в 0,012 кг (12 г) углерода 12. Масса моля эквивалентов называется молярной массой эквивалента (МЭ = г/моль).
Масса 1 эквивалента элемента называется его эквивалентной массой (mЭ).
Таким образом, эквиваленты выражаются в а.е.м., а эквивалентные массы – в г/моль.
Эквивалент элемента рассчитывают по формуле:

где А – атомная масса элемента;
В – степень окисления.
Элемент с переменной степенью окисления имеет несколько значений эквивалента.
Например, эквиваленты азота в соединениях равны соответственно: +2 +3 +5
NO, N2O3, N2O5

Эквиваленты сложных веществ рассчитывают по формуле:

где Мг – молекулярная масса вещества;
В – заряд функциональной группы;
n – число функциональных групп в молекуле.
Функциональными группами являются:
а) для солей – ионы металла (Меn+);
б) для кислот – ионы водорода (Н+);
в) для оснований – гидроксид – ионы (ОН-)
Поэтому эквивалент основания
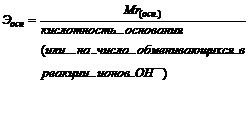


Эквивалент соли равен молекулярной массе этой соли, деленной на произведение числа ионов металла и его заряда:

Эквивалент химического соединения можно определять как сумму эквивалентов, составляющих его частей:
а) эквивалент основания равен сумме эквивалентов металла и группы ОН-;
б) эквивалент соли равен сумме эквивалентов металла и кислотного остатка;
в) эквивалент оксида равен сумме эквивалентов металла (или неметалла) и кислорода.
В уравнениях эквивалент может иметь различные значения. Это зависит от того в какую реакцию обмена вступит это вещество:
H3PO4 + NaOH = NaH2PO4 + H2O; 
H3PO4 + 2NaOH = Na2HPO4 + 2H2O; 
H3PO4 + 3NaOH = Na3PO4 + 3H2O; 
В окислительно-восстановительной реакции эквивалент вещества равен его молекулярной массе деленной на число потерянных (или приобретенных) одной молекулой электронов:
0 +1 +2 0
Mg + H2SO4 = MgSO4 + H2
РАЗБАВЛ.
 B Mg0 – 2e ®Mg2+ 2
B Mg0 – 2e ®Mg2+ 2
O 2H+ + 2e = H2 2

0 +6 +2 -2
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
КОНЦ.
 B Mg0 – 2e ®Mg2+ 8
B Mg0 – 2e ®Mg2+ 8
O S+6 + 8e = S-2 2

Вещества реагируют друг с другом в эквивалентных соотношениях. Эта закономерность была сформулирована немецким физиком Рихтером в 1794 году под названием закона эквивалентов:
Массы и объемы реагирующих веществ пропорциональны их эквивалентам:

Объем, занимаемый при данных условиях эквивалентной массой газообразного вещества, называется эквивалентным объемом.
Мольный объем (объем, занимаемый при данных условиях мольной массой газообразного вещества) любого газа при нормальных условиях равен 22,4 л.
 = 2 г/моль;
= 2 г/моль;  =1 г/моль.
=1 г/моль.
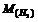 = 2 г/моль занимает объем 22,4 л;
= 2 г/моль занимает объем 22,4 л;
 = 1 г/моль занимает объем 11,2 л;
= 1 г/моль занимает объем 11,2 л;
 = 32 г/моль занимает объем 22,4 л;
= 32 г/моль занимает объем 22,4 л;
 = 8 г/моль занимает объем
= 8 г/моль занимает объем 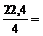 5,6 л
5,6 л
В тех случаях, когда в реакции участвуют газы закон эквивалентов выражается следующим соотношением:
 ,
,
где  и
и  – объемы 1–го и 2–го газов;
– объемы 1–го и 2–го газов;
 и
и  – эквивалентные объемы (объемы моля эквивалентов) 1–го и 2–го газов.
– эквивалентные объемы (объемы моля эквивалентов) 1–го и 2–го газов.
Если же одно из реагирующих веществ находится в твердом состоянии, а другое в газообразном, то закон эквивалентов выражается следующим равенством:

где m – масса твердого вещества;
MЭ – молярная масса эквивалента твердого вещества;
V – объем газообразного вещества;
 – эквивалентный объем.
– эквивалентный объем.
Раствор, содержащий один моль эквивалентов вещества в литре, называется “нормальным”.
Нормальная концентрация раствора выражается в моль/л и обозначается “Н”.
Закон эквивалентов для реакции mА + nВ = АmВn, протекающей в растворе, можно записать следующим образом:
VA×NA = VB×NB
где VA и VB – объемы реагирующих растворов;
NA и NB – их нормальные концентрации.
 2018-01-21
2018-01-21 630
630








