Білки є основним пластичним матеріалом, з якого будуються тканини тіла. Це дуже складні речовини; їх молекули складаються із залишків a–амінокислот, з'єднаних у довгі ланцюги (поліпептидні ланцюги). У кожну молекулу білка входять тисячі і десятки тисяч залишків амінокислот. До складу білків, їх входить близько 30 видів. У травному тракті білки розпадаються на окремі амінокислоти, що всмоктуються в організмі і з них будуються білки нашого тіла.
Окремі амінокислоти можуть в організмі переходити в інші, але вісім з них не можуть синтезуватися в організмі і повинні надходити з їжею. Їх називають незамінними. Для повного засвоєння білків у їжі повинні утримуватися всі незамінні амінокислоти в тих співвідношеннях, у яких вони входять до складу нашого організму. Такими повноцінними білками є багато білків м'яса, яєць, риби, молока. У більшості білків рослинного походження не вистачає окремих незамінних амінокислот.
Наприклад, у гречаній крупі бракує лейцину, у рисовій крупі і пшоні - лізину і т.д. Один продукт може доповнювати інший по вмісту незамінних амінокислот. Однак таке взаємне збагачення відбувається тільки в тому випадку, коли ці продукти надходять в організм із розривом у часі не більш ніж у 2 години.
Тому можна підвищити харчову цінність білків, комбінуючи страви в меню або продукти в рецептурі страви.
Склад молекули білків за формою молекули всі білки можна розділити на глобулярні та фібрилярні.
У молекулі будь-яких білків амінокислоти з'єднуються у визначеній послідовності, що називають первинною структурою білка. У глобулярних білках довгі (поліпептидні) ланцюги амінокислот осідають, утворюючи клубки. Це вторинна структура. Усередині глобули ланцюга амінокислот розташовані у визначеному порядку й утримуються неміцними (водневими) зв'язками - це третинна структура. Сумовий суміш усіх структур є четвертинною структурою білкової молекули.
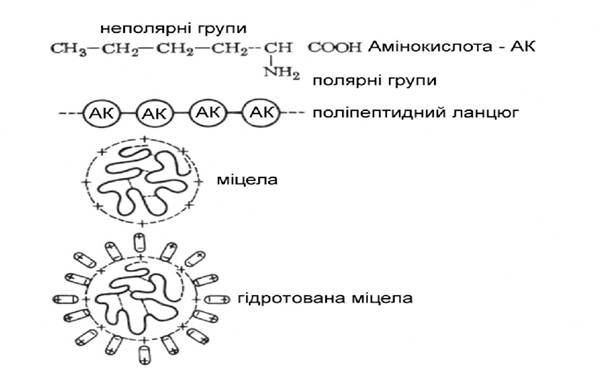
|
Рис. 2.1. Будова міцели глобулярних білків
Від того, як розташовані ланцюги a–амінокислот, в якому порядку розташовані в них a–амінокислоти і які групи атомів знаходяться на поверхні глобули, залежать властивості білків. До таких властивостей відносяться:
- гідратація, тобто здатність зв'язувати воду;
- розчинність (існують білки, розчинні у воді й соляних розчинах, глобуліни розчиняються тільки в соляних розчинах і т.д.);
- індивідуальні властивості (фарбування, ферментна активність і. др.);
- стійкість проти дії травних ферментів і ін.
У водних розчинах глобули білків, знаходячись у тепловому русі і зіштовхуючись один з одним, не можуть злипатися, збільшуватися і випадати в осад, тому що цьому перешкоджає ряд факторів.
По-перше, кожна частка (молекула) має заряд. Усі частки одного білка мають однаковий заряд, відштовхуються один від одного, і це перешкоджає їх збільшенню.
По-друге, полярні групи амінокислот (амінні - NH2, кислотні - СООН) притягають молекули води, і вони утворюють навколо частки захисну (гідратну) оболонку (молекулярний стабілізатор). У фібрилярних білків молекули складаються з витягнутих поліпептидних ланцюгів, які мають форму спіралі.
 2018-01-21
2018-01-21 1276
1276








