Первый закон термодинамики говорит о том, что невозможно получить работу без подвода энергии извне, в частности в форме теплоты, то есть закон устанавливает возможность взаимопревращений работы и теплоты, но не устанавливает особенности превращения теплоты в работу и работы в теплоту. Но работа в теплоту превращается легко, просто и без потерь, а для превращения теплоты в работу нужны сложные технические устройства, и это превращение теплоты всегда сопровождается потерями энергии. С точки зрения физики, различие кроется на уровне превращения упорядоченного движения в хаотическое (A®Q) и хаотического в упорядоченное (Q®A).
Все процессы в природе подразделяются на самопроизвольные и вынужденные. Самопроизвольные:падение давления в сосуде при разгерметизации, диффузия газов, передача теплоты от более к менее нагретому телу и т.д., и в общем случае – превращении работы в теплоту. Вынужденные: нагнетание давления, разделение газов и т.д., и в общем случае – превращение теплоты в работу.
Ранняя формулировка 2-ого закона термодинамики (формулировка Томсона): «Невозможно провести отрицательный (вынужденный) процесс без компенсации его положительным самопроизвольным процессом».
Например: таяние снега – вынужденный процесс, так как сопровождается самопроизвольным процессом передачи теплоты от более нагретого тела к менее нагретому (от Солнца к Земле).
Известны также другие формулировки второго закона термодинамики:
-«Каждый вынужденный процесс избегает одиночества и требует сопровождения себя самопроизвольным процессом»;
-«Невозможно построить тепловой двигатель, термический КПД которого превышал бытермический КПД цикла Карно»;
-«Энтропия в адиабатически изолированных системах всегда возрастает»;
-«Вечный двигатель второго рода невозможен».
Вечный двигатель второго рода – это двигатель, единственным источником теплоты для которого, являлась бы теплота окружающей среды. С точки зрения первого закона термодинамики это возможно, но второй закон термодинамики утверждает, что должно быть как минимум два источника теплоты: нагреватель (ВИТ) и холодильник (НИТ).
Идеальным тепловым двигателем – устройством, преобразующим теплоту в работу, является двигатель, работающий по прямому обратимому циклу Карно.
Эффективность любого теплового двигателя, с точки зрения этого преобразования, определяется по величине термического коэффициентаполезного действия.
Термическим КПД ( t) теплового двигателя называется отношение произведенной им полезной работы(Апол) к затраченной (подведенной) на это теплоте (Q1):
t) теплового двигателя называется отношение произведенной им полезной работы(Апол) к затраченной (подведенной) на это теплоте (Q1):
 t =Апол/ Q1 t =Апол/ Q1
|
Суммарное значение теплоты, отводимой при работе теплового двигателя, обозначается через Q2.
Отводимая теплота во всех процессах считается отрицательной.
Полезная работа в цикле равна сумме абсолютных работ, совершаемых во всех процессах цикла. Работа расширения (работа системы) считается положительной, а работа сжатия (работа над системой)-отрицательной.
Графически полезная работа в цикле изображается в PV-координатах как площадь внутри цикла.
Внутренняя энергия является функцией состояния, поэтому ее суммарное изменение в цикле равно нулю. Тогда первый закон термодинамики для цикла приобретает вид:
Апол = Q1 -[Q2].
С учетом последнего,термический КПД любых циклов (обратимых и необратимых) вычисляется по общей формуле

|
Графически часть подведенной теплоты (Q1 -[Q2]), преобразованная в цикле в полезнуюработу
Апол ,изображается вTS-координатах как площадь внутри цикла.
20.1 Прямой обратимый цикл Карно.
Рассмотрим прямой обратимый цикл Карно, состоящий из двух изотерм и двух адиабат.


Рисунок. Прямой обратимый цикл Карно
Для обратимых процессов выполняется соотношение dQ = TdS.
Интегрируя это соотношение для изотермических процессов (1 -2) и (3-4) получаем:
Q1 = T1(S2 – S1)-подведенная теплота;
Q2 = T2(S1 – S2)-отведенная теплота.
Тогда  ,
,
или
 t Карно=1- T2 / T1 t Карно=1- T2 / T1
|
Из полученного соотношения следует теорема Карно:
термический КПД обратимого цикла Карно не зависит от состава рабочего тела и определяется только температурами нагревателя T1(ВИТ) и холодильника T2 (НИТ ).
Из равенства  t =
t =  tКарно, для обратимых процессов следует соотношение:
tКарно, для обратимых процессов следует соотношение:

Рассмотрим произвольный прямой обратимый цикл 1-а-2-в-1 и разобьем его бесчисленным числом адиабат, добавим к ним элементарные изотермические участки и образуем таким образом бесчисленное количество элементарных обратимых циклов Карно:
P
a
1
b 2
| Элементарный прямой цикл Карно |
V
| рис. 18. Произвольный прямой обратимый цикл. |
Для элементарного обратимого цикла Карно уравнение  запишется в виде:
запишется в виде:

Проинтегрируем это уравнение по замкнутому контуру:
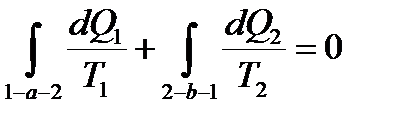
или

|
Из математики известно, что равенство нулю линейного интеграла по замкнутому контуру означает наличие полного дифференциала в качестве подинтегральной функции.
Так как для обратимых процессовdQ/Т = dS,то dS является полным дифференциалом, и,соответственно, энтропия является функцией состояния. ИзменениеS не зависит от пути перехода и определяется только ее значениямив начальном и конечном состояниях:
.
| ∆S=S2-S1 |
 2018-01-21
2018-01-21 875
875








