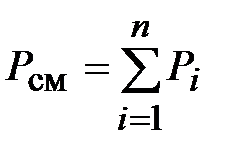 и
и 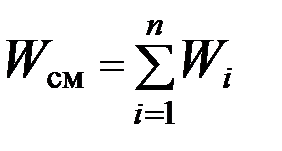 ,
,
где: Рi – парциальное давление, 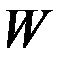 i– парциальный объем.
i– парциальный объем.
Каждый из идеальных газов смеси, находясь в объеме  и при температуре смеси
и при температуре смеси 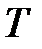 , отдельно и независимо от других создает некоторое давление
, отдельно и независимо от других создает некоторое давление  , называемое парциальным давлением.
, называемое парциальным давлением.
(Термин «парциальный» происходит от латинского partialis - частичный, отдельный)
Закон Дальтона: Общее давление смеси идеальных газов равно сумме парциальных давлений газов, составляющих смесь.
Уравнение состояния i-го газа при использовании понятия «парциальное давление» запишется следующим образом:
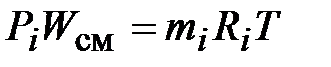
или 
Типичной студенческой ошибкой является подстановка в это уравнение вместо объема смеси  , парциального объема
, парциального объема 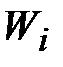 .
.
22.4.3.Парциальный объем.
Для сравнения количества газов в смеси по объему, необходимо их объемы при температуре смеси привести к одинаковому давлению.
Если этим одинаковым давлением является давление смеси  , то приведенные к этому давлению объемы компонентов называются парциальными.
, то приведенные к этому давлению объемы компонентов называются парциальными.
Парциальный (приведенный) объем  - это объем, который занимал бы i -тый компонент, если бы он один находился при температуре
- это объем, который занимал бы i -тый компонент, если бы он один находился при температуре  и давлении смеси
и давлении смеси 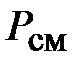 .
.
Для понимания физического смысла парциального объема рассмотрим смесь двух идеальных газов. Как отмечалось ранее, молекулы обоих газов равномерно распределены по всему объему  , занимаемому смесью при давлении
, занимаемому смесью при давлении 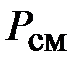 и температуре
и температуре 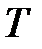 .
.
Представим себе, что каким-то образом удалось разделить молекулы этих двух газов так, что в общем объеме 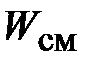 первый газ занимает объем
первый газ занимает объем 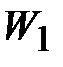 , а второй -
, а второй - 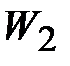 при одинаковой температуре
при одинаковой температуре 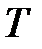 . Для того, чтобы эта гипотетическая система находилась в равновесии и газы не смешивались за счет разности давлений, давление в объемах
. Для того, чтобы эта гипотетическая система находилась в равновесии и газы не смешивались за счет разности давлений, давление в объемах 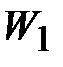 и
и  должно быть одинаковым и равным общему давлению смеси
должно быть одинаковым и равным общему давлению смеси  , т. е.
, т. е.
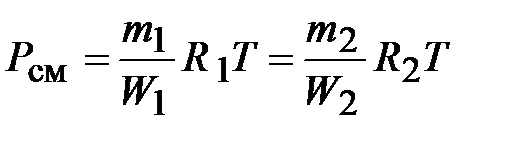
Или в общем случае 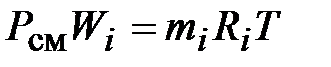
Типичной студенческой ошибкой является подстановка в это уравнение вместо давления смеси 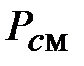 величины парциального давления
величины парциального давления  .
.
 2018-01-21
2018-01-21 762
762








