ЕЛЕКТРОХІМІЧНІ ПРОЦЕСИ
МЕТА РОБОТИ: Експериментально дослідити роботу гальванічних елементів.
ДОСЛІД 1 Мідно-цинковий гальванічний елемент
Виконання досліду
1.Одну склянку заповнити 1М розчином ZnSO4, а другу – 1М розчином CuSO4.
2.Сполучити склянки, як показано на рис. 4, за допомогою електролітного містка 3, що містить насичений розчин КСl у суміші із агар-агаром.
3.Занурити у розчин ZnSO4 цинкову пластинку, а у розчин CuSO4 – мідну; з’єднати обидві пластинки металевою дротиною з гальванометром 4.
4.Спостерігати відхилення стрілки, що вказує на виникнення електричного струму внаслідок протікання електрохімічних процесів.
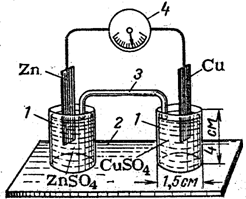
Рисунок 4 – Гальванічний елемент: 1 – склянки з розчинами солей; 2 – підстава; 3 – еклектролітичний місток; 4 – гальванометр.
Запис даних досліду
1.Вказати, який електрод є анодом, а який – катодом. Чому?
______________________________________________________________________
____________________________________________________________________________________________________________________________________________
2.Написати рівняння електродних процесів і сумарне рівняння хімічної реакції, внаслідок якої виникає електричний струм.
______________________________________________________________________
____________________________________________________________________________________________________________________________________________
3.Визначити напрямок переміщення електронів у зовнішньому ланцюгу і напрямок переміщення іонів у розчинах.
______________________________________________________________________
____________________________________________________________________________________________________________________________________________
4.Розрахувати теоретичне значення ЕРС (стандартний електродний потенціал φ оZn2+/Zn= - 0,76B, φ oCu2+/Cu= +0,34B); і порівняти його з експериментально одержаною величиною.
______________________________________________________________________
____________________________________________________________________________________________________________________________________________
5.У виводах зазначити причини, що можуть зумовлювати різницю між розрахованим і одержаним значенням ЕРС.
______________________________________________________________________
____________________________________________________________________________________________________________________________________________
ДОСЛІД 2 Концентраційний гальванічний елемент
Виконання досліду
1.Наповнити склянки 1 (рис.4) розчинами ZnSO4 різної концентрації: першу склянку – 1М ZnSO4, а другу – 0,01М ZnSO4.
2.З’єднати склянки електролітичним містком 3.
3.Занурити у кожну склянку цинкові пластинки і сполучити їх дротом з гальванометром 4.
4.Спостерігати відхилення стрілки.
Запис даних досліду
1. Обчислити теоретичні значення анодного і катодного потенціалів за рівнянням Нернста, вважаючи концентрації електролітів такими: [Zn2+]А = 0,01М, [Zn2+]K=1моль/л.
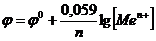 =____________________________________________________________________
=____________________________________________________________________
де φо – стандартний електродний потенціал (φ оZn2+/Zn= - 0,76B)
2. Написати схему концентраційного гальванічного елемента, відмітивши анод і катод, а також концентрації розчинів в яких вони знаходяться. Записати рівняння електродних процесів.
______________________________________________________________________
____________________________________________________________________________________________________________________________________________
______________________________________________________________________
____________________________________________________________________________________________________________________________________________
2.Обчислити ЕРС. Порівняти ЕРС з практично одержаною величиною.
______________________________________________________________________
______________________________________________________________________
3. В висновках зазначити за рахунок чого в концентраційному гальванічному елементі виникає електричний струм.
______________________________________________________________________
____________________________________________________________________________________________________________________________________________
ДОСЛІД 3 Утворення гальванічних пар при хімічних процесах
Виконання досліду
1.Внести в пробірку 1 мл 2 н сульфатної кислоти Н2SO4 і гранулу цинку. Спостерігати виділення газу водню.
2.Доторкнутися мідним дротиком до цинку в пробірці. Як змінюється інтенсивність виділення водню? На якому металі виділяється водень?
3.Видозмінити дослід. Для цього з пробірки де знаходиться цинк прибрати мідний дротик, а. в пробірку додати 5-6 краплин розчину CuSO4. Спостерігати більш інтенсивне виділення водню в присутності CuSO4. Що виділяється на поверхні цинкової гранули під час даної реакції?
Запис даних досліду
1. Записати рівняння реакцій що відбуваються при взаємодії цинку з розчином сульфатної кислоти, та в присутності CuSO4
________________________________________________________________________________
______________________________________________________________________
2. Скласти рівняння електродних процесів, що відбуваються при утворенні гальванічних пар.
______________________________________________________________________________
______________________________________________________________________________
3. У висновку пояснити причини більш інтенсивного виділення водню в присутності: а) мідного дротика; б) розчину CuSO4
______________________________________________________________________
____________________________________________________________________________________________________________________________________________
______________________________________________________________________
____________________________________________________________________________________________________________________________________________
ДОСЛІД 4. Корозія оцинкованого і лудженого заліза
Виконання досліду
1.Внести в дві пробірки по 2 мл дистильованої води і додати в кожну по 1-2 краплин 2 н сульфатної кислоти Н2SO4 і 1-2 краплини розчину К3[Fe(CN)6].
2. Два ЗРАЗКИ оцинкованого та луженого (вкритого оловом) заліза занурити в приготовлені розчини. Спостерігати появу синього забарвлення в одній з пробірок.
Запис даних досліду
1. Записати рівняння електродних процесів, що відбуваються при корозії в кислому середовищі в гальванопарах: залізо – цинк; залізо – олово.
________________________________________________________________________________
______________________________________________________________________
2. Пояснити, з виникненням яких іонів пов’язане синє забарвлення розчину? Вказати в якому випадку спостерігається корозія заліза. Пояснити причини такого явища.
______________________________________________________________________
____________________________________________________________________________________________________________________________________________
3. У висновку зазначити, при локальному руйнуванні якого захисного покриття буде протікати корозія заліза? Як називається такий вид захисного покриття?
______________________________________________________________________
____________________________________________________________________________________________________________________________________________
______________________________________________________________________
 2018-01-21
2018-01-21 455
455








