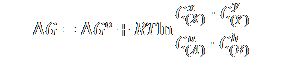 Для процесса в общем виде:
Для процесса в общем виде:
D G = 0
D G° = -RTlnKр
Принцип подвижного равновесия
При изменении одного из условий химического равновесия оно смещается в сторону той реакции, которая уменьшает произведённое изменение.
Принцип адаптивных перестроек
Любая живая система при воздействии на неё перестраивается так, чтобы уменьшить это воздействие
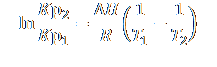 Уравнение изобары химической реакции
Уравнение изобары химической реакции
Лекция №5 Элементы химической кинетики.
Кинетика - раздел химии, изучающий механизмы химических реакций и скорости их протекания.
Скорость - основное понятие кинетики.
Для реакции в общем виде
aA + bB ® xX + yY
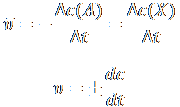 скорость описывается кинетическим уравнением:
скорость описывается кинетическим уравнением:
Факторы, влияющие на скорость
1. Природа реагирующих веществ: определяется видом частиц (атомы, молекулы, ионы).
2. Концентрация реагирующих веществ: описывается законом действующих масс (ЗДМ)
3. Температура: описывается правилом Вант-Гоффа
Основные положения теории активных соударений
Для эффективного взаимодействия частицы должны:
1. столкнуться;
2. иметь благоприятную ориентацию;
Обладать достаточной энергией.
Еа - минимальная энергия частиц, достаточная для того, чтобы частицы вступили в реакцию.
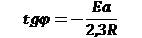 Способы расчёта Еа:
Способы расчёта Еа:
1. По уравнению Аррениуса.
2. Графический
 2018-01-21
2018-01-21 620
620








