Его формулировки: 1. Энергия не создаётся и не уничтожается, а переходит из одной формы в другую.
Переход из одного вида в другой происходит в строго эквивалентных количествах.
Полная энергия изолированной системы - величина постоянная
| DH = DE + pDV |
Теплота, подведённая к системе, расходуется на увеличение внутренней энергии и на совершение ею работы против внешних сил
Способы определения DН:
1. Калориметрия - экспериментальный способ определения DН.
2. Закон Гесса - изменение энтальпии в химической реакции зависит только от вида и состояния исходных веществ и продуктов и не зависит от путей перехода из одного состояния в другое.
Следствия из закона Гесса
 I-ое следствие:
I-ое следствие:
II-ое следствие:
DH°(стандартная энтальпия) = 0 для простых веществ и элементов в стандартных условиях (Т=298К, р=101,3 кПа, n=1моль).
(Тоже самое только вместо образ.à сгор.)
Лекция №3
Второе начало термодинамики.
I закон термодинамики позволяет определить DHреакции, но не даёт ответа на вопрос о её направлении. Ответ на этот вопрос даёт II закон термодинамики, который выделяет теплоту в особый вид энергии и вводит понятие энтропии.
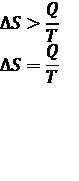 Энтропия (S) - мера рассеянной или обесцененной энергии.
Энтропия (S) - мера рассеянной или обесцененной энергии.
В самопроизвольном процессе
В равновесном процессе
Для изолированной системы, где Q = 0:
В самопроизвольном процессе DS > 0
В равновесном процессе DS = 0
В общем случае в изолированной системе
DS ³ 0
В 1872 г. Л.Больцман предложил статистическую формулировку второго закона термодинамики:
«Изолированная система эволюционирует преимущественно в направлении большей термодинамическоой вероятности
| DG = DH - TDS Уравнение Гиббса |
При D G < 0 реакция возможна;
При D G > 0 реакция невозможна;
При D G = 0 система находится в равновесии
| Знак DH | Знак DS | Знак DG | Возмож-ть самопроизв. реакции |
| + | - | + | Нет |
| - | + | - | Да |
| - | - | - | Зависит от соотношения DH и TDS |
Реакции обмена
Экзэргонические - реакции обмена, идущие с выделением энергии (DG<0).
Эндэргонические - реакции обмена, идущие с потреблением энергии (DG>0).
Лекция №4 Химическое равновесие
Критерии равновесия
Для химической реакции общего вида
aA + bB «xX + yY
состояние равновесия может быть описано и с точки зрения кинетики и с точки зрения термодинамики. С точки зрения термодинамики макроскопические системы достигают равновесия, когда изменение энергии компенсируется энтропийной составляющей.
Для постоянного давления и температуры: DH = TDS, тогда D G = 0.
С точки зрения кинетики состояние равновесия характеризуется величиной константы равновесия:
 2018-01-21
2018-01-21 436
436








