Закон Вант-Гоффа
p = сRТ
Осмотическое давление раствора равно тому давлению, которое производило бы растворённое вещество, если бы оно при той же Т находилось в газообразном состоянии и занимало V, равный Vраствора.
Изотонический коэффициент
Для реальных растворов математические выражения, характеризующие коллигативные свойства, могут быть использованы с учётом изотонического коэффициента (i).
Для неэлектролитов i = 1, для электролитов i > 1, для коллоидов i < 1.
Способы нахождения
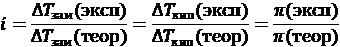 1. Экспериментально:
1. Экспериментально:
Лекция №8 Протолитическая и электронная теории кислот и оснований.
Теория Бренстеда - Лаури (Б-Л), предложенная в 1923 г., определяет кислоты и основания по отношению к одному партнёру - Н+. Поэтому кислоты и основания называются протолитами; обратимые реакции, в которых осуществляется перенос протонов, - протолитическими равновесиями, а теория Б-Л - протолитической теорией.
Кислоты и основания Б-Л
Кислота - протон-донорное вещество.
Основание - протон-акцепторное вещество.
Кислоту и основание, связанные приведённым соотношением, называют сопряжённой кислотно-основной парой
Направление протолитического равновесия устанавливается в результате конкуренции за Н+ между основаниями сопряжённых кислотно-основных пар и всегда смещается в сторону более слабой кислоты.
Роль растворителя в протолитических равновесиях
В растворе вещество не может реагировать как кислота, если нет основания, роль которого может выполнять растворитель (Н2О).
СН3СООН + Н2О à СН3 СОО- + Н3О+
NH3 + H2O à NH4+ + OH-
Автопротолиз
Из этого следует, что Н2О является амфолитом, а процесс:
Н2О+ Н2О«Н3О+ + ОН-
называется автопротолизом, характеризующимся const (Kw) / ионным произведением воды.
Kw = [OH-] × [H+] = 10-14
рН - отрицательный десятичный логарифм концентрации ионов водорода pH = -lg[H+]
Виды кислотностей
АК - молярная концентрация эквивалентов свободных ионов Н+ в растворе
ТК - молярная концентрация эквивалентов всех кислот в растворе, определяемых титрованием.
ПК - молярная концентрация эквивалентов недиссоциированных молекул кислоты.
ОК - сумма титруемой кислотности и молярной концентрации эквивалентов кислот Б-Л, неопределяемых титрованием.
 2018-01-21
2018-01-21 614
614








