В простейшем случае под координационными понимают соединения, образующиеся при взаимодействии более простых неизменных частиц (атомов, ионов или молекул), каждая из которых способна существовать независимо в обычных условиях. Соответственно реакции, в результате которых образуются координационные соединения, носят название реакций комплексообразования.
Например, ион Cu2+ взаимодействует в растворе с молекулами NH3 по обратимой реакции с образованием сложного катиона:
Cu2+ + 4NH3 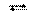 [Cu(NH3)4]2+,
[Cu(NH3)4]2+,
а ион Fe2+ легко присоединяет цианид-ионы, образуя сложный анион:
Fe2+ + 6CN 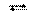 [Fe(CN)6]4.
[Fe(CN)6]4.
Кроме того, две молекулы BF3 и NH3 могут взаимодействовать с образованием более сложной частицы:
BF3 + NH3 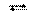 [B(NH3)F3].
[B(NH3)F3].
Образовавшиеся соединения в результате таких реакций приобретают новые свойства, в частности, например, совершенно иную окраску, растворимость и способность взаимодействовать с различными реагентами.
Координационные соединения используются практически во всех областях химии и во многих технологических процессах (рис.).
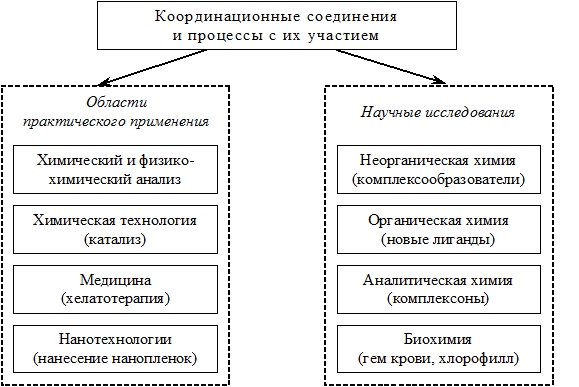
Рис. Схема, иллюстрирующая современные пути использования координационных соединений в промышленности и научных исследованиях
Координационными называют соединения, содержащие в одном из агрегатных состояний группу ионов или нейтральных молекул (лигандов), в определенном порядке размещенных (координированных) вокруг центрального атома (иона) – комплексообразователя, в качестве которого в большинстве случаев выступает атом металла.
Система комплексообразователь – лиганды называется внутренней координационной сферой, обычно отделяемой квадратными скобками от внешней координационной сферы:
K4[Fe(CN)6], [Cr(NH3)6]Cl3, [PtCl2(NH3)2], [Cr(CO)6].
Внешнюю координационную сферу составляет определенное количество противоположно заряженных частиц, а иногда и дополнительное количество молекул. Например, в тригидрате гексацианоферрата(II) калия K4 [ Fe(CN)6 ] ·3H2O роль комплексообразователя выполняет железо(II), а в роли лигандов выступают шесть одинаковых цианогрупп CN–. Вместе атом железа(II) и шесть цианогрупп образуют внутреннюю координационную сферу комплекса, что в написанной формуле обозначено квадратными скобками. Во внешней сфере в данном случае находятся четыре иона калия, компенсирующие отрицательный заряд внутренней сферы [ Fe(CN)6 ] 4–, и три молекулы воды.
К важнейшим параметрам координационных соединений относятся заряд комплекса, координационное число и дентатностьлигандов (координационная емкость).
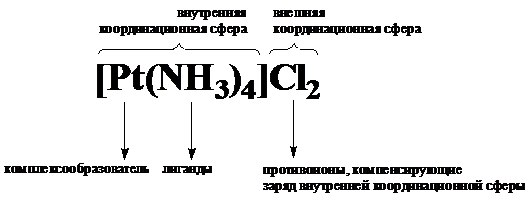
Рис. Терминологическое описание строения координационных соединений
Заряд комплекса (комплексной частицы) определяется алгебраической суммой зарядов центрального атома – комплексообразователя и координированных вокруг него лигандов.
Например, для [Pt4+Cl6–] z заряд z = 4 + 6·(–1) = –2; для [Ag+(CN)2–] z заряд z = 1 + 2·(–1) = –1 и т.д.
О заряде комплексной частицы можно также судить по суммарному заряду частиц во внешней сфере комплекса: он равен суммарному заряду во внешней сфере с противоположным знаком. Например, для К4[Fe(CN)6] заряд комплексной частицы z = –4·1 = –4.
Координационное число (КЧ) определяется количеством лигандов, непосредственно присоединенных к центральному атому. КЧ зависит от характеристик как центрального атома – комплексообразователя, так и лигандов, а также от характера и направленности связей между ними в пространстве. Между значениями координационного числа и степенью окисления элемента-комплексообразователя существует определенная зависимость (табл. 9.1).
Таблица. Наиболее распространенные координационные числа (в скобках приведены координационные числа, реализуемые относительно реже).
| Степень окисления центрального атома | Координационные числа | Примеры |
| +1 +2 +3 +4 | 2 (3) 4 (6) 6 (4) 6 (8) | [Ag(NH3)2]+, [Cu(CN)2]-, [IBr2]- [Zn(NH3)4]2+, [PtCl4]2-, [Pd(NH3)2Cl2]0, [ZnI4]2-, [Cu(NH3)4]2+, [Fe(H2O)6]2+, [Mg(H2O)6]2+, [Ni(H2O)6]2+. [Co(NH3)6]3+, [Cr(OH)6]3-[AlF6]3-, [Fe(CN)6]3-. [PtCl6]2-, |
Известны комплексообразователи, которые обладают практически постоянным координационным числом в комплексах разных типов, например, Co(III), Cr(III) или Pt(IV) с КЧ 6 и B(III), Pt(II), Pd(II), Au(III) с КЧ 4. Тем не менее большинство комплексообразователей имеет переменное координационное число. Например, для Al(III) возможны КЧ 4 и КЧ 6 в комплексах [Al(OH)4]- и [Al(H2O)2(OH)4]-.
Координационные числа 3, 5, 7, 8 и 9 встречаются сравнительно редко. Есть всего несколько соединений, в которых КЧ равно 12 – например, таких как K9[Bi(NCS)12].
Дентатность лигандов. Лиганды характеризуются дентатностью, под которой подразумевается число связей между лигандом и центральным атомом – комплексообразователем. Различают моно -, би - и, в общем случае, полидентатные лиганды.
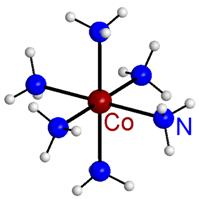
К числу монодентатных лигандов, т.е. занимающих одно координационное место во внутренней сфере комплекса, относятся H2O, NH3, С2Н5ОН, другие полярные молекулы, однозарядные анионы CN–, Hal–, OH– и т.п.
Бидентатными, занимающих два координационных места, являются еn (этилендиамин NH2–CH2–CH2–NH2), Gly (глицинат NH2–CH2–COO–), двухзарядные анионы SO42–, CO32–, C2H42–, SО32– и др.
Имеется большое количество полидентатных лигандов органической природы. Примерами могут служить тридентатный диэтилентриамин NH2–CH2–CH2–NH–CH2–CH2–NH2 и тетрадентатный лиганд НООС–CH2–NH–CH2–CH2–NH–CH2–СООН. Важными тетрадентатными лигандами являются порфирины, фталоцианины и их различные структурные аналоги.
С учетом дентатности координационное число комплексообразователя равно произведению числа лигандов во внутренней координационной сфере комплекса на их дентатность.
Таблица. Классические подходы к классификации координационных соединений
| Классификационный признак | Типы | Примеры |
| Класс химического соединения | 1. Соли 2. Кислоты 3. Основания | [Co(NH3)5Br]SO4, Pt(NH3)5Cl]Cl3 H[AuCl4], H2[SiF6] [Pt(NH3)4SO4](OH)2, [Ag(NH3)2]OH |
| Заряд комплексной частицы | 1. Катионные 2. Анионные 3. Катион-анионные 4. Нейтральные | [Cr(NH3)]Cl3 K4[Fe(CN)6] [Cr(NH3)6][Fe(CN)6] [PtCl2(NH3)2] |
| Природа координируемого лиганда | 1. Аквакомплексы 2. Гидроксокомплексы 3. Аммиакаты (аммины) 4. Ацидокомплексы 5. Анионгалогенаты 6. Катионгалогены 7. Гидридные комплексы 8. Карбонильные 9. p-комплексы 10. Хелаты 11. Полиядерные комплексы | [Be(H2O)4]SO4, [Cr(H2O)6]Cl3 К2[Zn(OH)4], Na[Al(OH)4] [Cu(NH3)4](OH)2, [Co(NH3)6]Cl2 K3[Co(NO2)6], K4[Fe(CN)6] Cs[I(I)2], NH4[ICl4] [ICl2][SbCl6], [BrF2][AsF6] Na[AlH4], К[BH4] [Cr(CO)6], [Mo(CO)6] [Fe(C5H5)2], [Cr(C6H6)] [Cr(en)2(Cl)2]Cl K4[Re2Cl8]K4[Cl4Re–ReCl4] |
Номенклатура координационных соединений
Современная номенклатура комплексных соединений основана на рекомендациях IUPAC (Международный союз общей и прикладной химии).
Названия лигандов. Названия анионных лигандов получают концевую гласную - о, которой сопровождается название соответствующего аниона или корня названия аниона (табл.).
Таблица. Названия анионных лигандов
| Лиганд | Название | Лиганд | Название |
| CH3COO- CN- CO32- C2O42- Cl- H+ | ацетато циано карбонато оксалато хлоро гидридо | NO NO2- O22- OH- SO32- SO3S2- | нитрозо нитро пероксо гидроксо сульфито тиосульфато |
Некоторые анионные лиганды имеют специальные названия, например O2- - оксо, S2- - тио, HS- - меркапто.
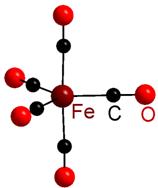
Для названий нейтральных лигандов используются номенклатурные названия веществ без изменений (N2 - диазот, N2H4 - гидразин, C2H4 - этилен и т.д.), за исключением: H2O - аква, NH3 - амин, NO - нитрозил, CO - карбонил, SO2 - диоксосера, PF3 - трифторофосфор.
Название комплексных анионов составляется из перечисления лигандов, корня латинского наименования центрального атома (иона) и суффикса –ат (табл.); в скобках римской цифрой обозначается степень его окисления или заряд координационного иона (по Штоку).
Например: [BF4]- - тетрафтороборат(III)-ион, [Al(H2O)2(OH)4]- - тетрагидроксодиакваалюминат(III)-ион, [VS4]3- - тетратиованадат(V)-ион, [Fe(CN)6]3- - гексацианоферрат(III)-ион, [Ag(SO3S)2]3- - бис(тиосульфато)аргентат(I)-ион. Названия соединений, содержащих комплексные анионы, строятся следующим образом: K2[HgI4] – тетраиодомеркурат(II) калия, H[Sb(OH)6] - гексагидроксостибат(V) водорода, K2[CuCl4] – тетрахлорокупрат(II) калия, [Cr(H2O)6]Cl3 – хлорид гексааквахрома(III).
Таблица. Названия комплексных катионов некоторых элементов.
| Элемент | Название | Элемент | Название |
| B Al Ti V Cr Mn Fe Co Ni | борат алюминат титанат ванадат хромат манганат феррат кобальтат никелат | Cu Zn Ag Sn Au Hg Pb Bi | купрат цинкат аргентат станнат аурат меркурат плюмбат висмутат |
Названия комплексных катионов состоят из числа и названия лигандов и названия комплексообразователя.
Например, [Ag(NH3)2]+ - катион диамминсеребра(I), [Cr2(NH3)9(OH)2]4+ - катион дигидроксононаамминдихрома(III), [Mn(H2O)6]2+ - катион гексааквамарганца(II), [Pt(en)2]2+ - катион бис(этилендиамин)платины(II). Названия соединений, содержащих комплексный катион, строятся следующим образом: [Hg2(H2O)2](NO3)2 – нитрат диаквадиртути(II), [Mn(H2O)6] SO4 - сульфат гексааквамарганца(II), [Ag(NH3)2]OH - гидроксид диамминсеребра(I), [Cr2(NH3)9(OH)2]Cl4 - хлорид дигидроксононаамминдихрома(III).
Названия нейтральных комплексов, или комплексов без внешней координационной сферы, состоят из одного слова. Сначала указывается число и названия лигандов (для лигандов каждого вида отдельно), затем название центрального атома в именительном падеже. Например: [Al2Cl6] – гексахлородиалюминий, [Co2(CO)8] – октакарбонилдикобальт, [Fe(C5H5)2] – бис(циклопентадиенил)железо, [Mo6Cl14] – 14-хлорогексамолибден, [Ni(CO)4] – тетракарбонилникель, [Zn(py)2Cl2] –дихлоробис(пиридин)цинк.
 2018-01-21
2018-01-21 3056
3056
