В лабораторной практике часто ставится задача определения состава соединения и его отнесения к двойным или комплексным солям. Например, при охлаждении водного раствора, содержащего хлориды калия и магния, кристаллизуется карналлит – двойная соль состава KCl∙MgCl2∙6H2O, которая в водном растворе диссоциирует согласно уравнению:
KCl∙MgCl2∙6H2O → [K(H2O)6]+ + [Mg(H2O)6]2+ + 3Cl-.
Точно так же при растворении в воде двойной соли – алюмоцезиевых квасцов состава CsAl(SO4)2∙12H2O происходит полная диссоциация:
CsAl(SO4)2∙12H2O → [Cs(H2O)6]+ + [Al(H2O)6]3+ + 2SO42-.
И в растворе, и в кристаллах (в узлах кристаллической решетки) у этого соединения обнаруживаются аквакомплексы [Cs(H2O)6]+ и [Al(H2O)6]3+. Поэтому координационную формулу этого соединения следует записывать как [Cs(H2O)6][Al(H2O)6](SO4)2, а называть его сульфатом гексаакваалюминия-гексааквацезия. Что же касается карналлита, его точное название хлорид гексааквамагния-калия, а формула – K[Mg(H2O)6]Cl3.
В то же время при охлаждении водного раствора, содержащего хлориды калия и меди(II), кристаллизауется соединение, которое и в кристаллическом состоянии, и в растворе содержит комплексный анион [CuCl4]2-, полная константа образования К 4 которого равна 1,6∙105. Следовательно, формулу кристаллизующегося в этом случае соединения надо записывать как K2[CuCl4] – тетрахлорокупрат(II) калия.
Таким образом, различие между комплексными соединениями и двойными солями состоит в том, что последние не координируют или очень слабо координируют анионные лиганды, и носит чисто количественный характер – они отличаются по значениям полных констант образования.
Простейшими способами получения координационных соединений являются реакции присоединения, замещения и отщепления лигандов. Реакции присоединения являются наиболее часто используемым методом получения комплексных частиц, например:
Cu2+ + 4NH3 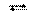 [Cu(NH3)4]2+,
[Cu(NH3)4]2+,
Fe3+ + 6F- 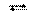 [FeF6]3-.
[FeF6]3-.
В действительности, реакции присоединения являются реакциями замещения в комплексных аквакатионах слабо связанных с комплексообразователем молекул воды (для водных растворов):
[Cu(H2O)4]2+ + 4NH3 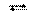 [Cu(NH3)4]2+ + 4H2O,
[Cu(NH3)4]2+ + 4H2O,
[Fe(H2O)6]3+ + 6F- 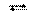 [FeF6]3- + 6H2O.
[FeF6]3- + 6H2O.
Образование координационных соединений в растворах возможно также и из нерастворимых солей катиона – комплексообразователя. Например, при добавлении водного раствора аммиака к белому осадку хлорида серебра(I) образуется бесцветный устойчивый ион диамминсеребра(I), при этом осадок AgCl растворяется:
AgCl(тв) + 2NH3∙H2O 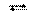 [Ag(NH3)2]+ + Cl- + 2H2O.
[Ag(NH3)2]+ + Cl- + 2H2O.
В этом случае концентрация ионов Ag+, присутствующих в насыщенном растворе AgCl за счет фазового равновесия
AgCl(тв) 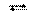 Ag+ + Cl-,
Ag+ + Cl-,
будет уменьшаться из-за их связывания в прочные комплексные катионы диамминсеребра(I) с К 2, равной 1,6∙107. В результате произведение концентраций Ag+ и Cl- становится ниже значения произведения растворимости AgCl (1,78∙10–10), и осадок растворяется.
Голубой осадок гидроксида меди(II) под действием водного раствора аммиака также переходит в растворимое координационное соединение интенсивного синего цвета:
Cu(OH)2 + 4NH3∙H2O 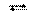 [Cu(NH3)4]2+ + 2OH- + 4H2O,
[Cu(NH3)4]2+ + 2OH- + 4H2O,
так как ион меди(II) образует устойчивый комплексный катион [Cu(NH3)4]2+ с константой образования К 2, равной 7,9∙1012. Процесс образования комплекса отвечает следующим реакциям:
Cu(OH)2(тв) 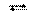 Cu2+ + 2OH-,
Cu2+ + 2OH-,
Cu2+ + 4NH3∙H2O 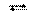 [Cu(NH3)4]2+ + 4H2O.
[Cu(NH3)4]2+ + 4H2O.
В растворе, содержащем комплексные катионы [Cu(NH3)4]2+, концентрация ионов Cu2+ весьма мала и недостаточна для достижения значения произведения растворимости гидроксида меди(II) (ПР = 5,6∙10-20). Но при добавлении к раствору [Cu(NH3)4]2+ раствора сульфида аммония выпадает черный осадок CuS (ПР = 1,4∙10-36), и комплексный ион разрушается:
[Cu(NH3)4]2+ 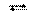 Cu2+ + 4NH3,
Cu2+ + 4NH3,
Cu2+ + S2- 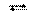 CuS(т),
CuS(т),
в суммарном виде:
[Cu(NH3)4](OH)2 + (NH4)2S + 4H2O 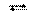 CuS(т) + 6NH3∙H2O.
CuS(т) + 6NH3∙H2O.
Таким образом, концентрация ионов Cu2+, образующихся при диссоциации комплекса – иона тетраамминмеди(II), является достаточной для достижения произведения растворимости сульфида меди(II). Сульфид-ионы связывают ионы меди в осадок, практически нерастворимый в воде, концентрация Cu2+ понижается, и равновесие диссоциации [Cu(NH3)4]2+ смещается вправо, что приводит в конечном счете к разрушению комплекса.
Образование одного более устойчивого координационного соединения может привести в полной диссоциации и разрушению другого, менее устойчивого комплекса. Например, реакция:
[Ag(NH3)2]Cl + 2KCN 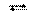 K[Ag(CN)2] + KCl + 2NH3,
K[Ag(CN)2] + KCl + 2NH3,
является практически необратимой из-за большого значения константы образования дицианоаргентат(I)-иона. Полные константы образования катиона диамминсеребра(I) и дицианоаргентат(I)-иона равны соответственно 1,6∙107 и 7,1∙1019. Это значит, что комплексный ион [Ag(CN)2]- прочнее, чем [Ag(NH3)2]+.
Приведенные примеры явно иллюстрируют тот факт, что возможность образования координационного соединения в значительной мере зависит от значения полной константы образования Кn. Чем оно больше, тем меньше в растворе свободных ионов комплексообразователя, тем прочнее, устойчивее к воздействию других веществ будет данный комплекс.
 2018-01-21
2018-01-21 647
647







