В растворах координационных соединений могут происходить разнообразные превращения, определяемые природой как комплексной частицы, так и растворителя. В водных растворах координационные соединения подвергаются электролитической диссоциации. При этом различают первичную диссоциацию (по типу сильных электролитов):
[Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl–
(внешнесферное равновесие),
и вторичную диссоциацию (по типу слабых электролитов):
[Ag(NH3)2]+ 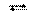 [Ag(NH3)]+ + NH3,
[Ag(NH3)]+ + NH3,
[Ag(NH3)]+ 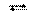 Ag+ + NH3,
Ag+ + NH3,
в суммарном виде:
[Ag(NH3)2]+ 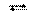 Ag+ + 2NH3
Ag+ + 2NH3
(внутрисферное равновесие).
Ионы внешней сферы, образующиеся в растворе в результате первичной диссоциации, можно легко обнаружить обычными методами химического анализа. Составные же части комплексного иона химическими методами не обнаруживаются.
Например, если в раствор красной кровяной соли K3[Fe(CN)6] добавить щелочь, то выпадения бурого осадка Fe(OH)3 не происходит, т.к. в растворе ионы Fe3+ присутствуют в ничтожном количестве из-за вторичной диссоциации комплексного иона.
Для описания устойчивости координационных соединений в водных растворах используют константу устойчивости К – величину, характеризующую глубину протекания равновесия образования комплекса.
Термин «константа устойчивости» применяется потому, что большей величине константы соответствует большая концентрация комплекса при равновесии, она является мерой ассоциации частиц и применяют ее обычно для описания равновесия образования комплексов. Например, для равновесия:
M z + + L 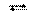 ML z +,
ML z +,
константа устойчивости определяется как отношение концентрации комплексной частицы к произведению равновесных концентраций исходных иона металла и лиганда:
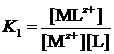 .
.
Как следует из представленного выражения, размерность величин констант равновесия К, обратна размерности концентрации.
 2018-01-21
2018-01-21 1144
1144
