Все многообразие координационных соединений обусловлено образованием изомеров – соединений, одинаковых по составу, но различающихся расположением лигандов вокруг центрального иона. Рассмотрим основные виды изомерии координационных соединений.
Гидратная изомерия обусловлена различным расположением молекул воды и анионных лигандов между внутренней и внешней координационными сферами.
Например, CrCl3∙6H2O в растворах существует, по крайней мере, в трех изомерных формах: [Cr(H2O)6]Cl3 – трихлорид гексааквахрома (III) (фиолетовый цвет раствора), [CrCl(H2O)5]Cl2∙H2O – моногидрат дихлорид пентааквахлорохрома (III) (светло-зеленый), [CrCl2(H2O)4]Cl∙2H2O – дигидрат хлорид тетрааквадихлорохрома (III) (темно-зеленый). Количественный состав внешней координационной сфер по хлору можно наблюдать в простейшем эксперименте. Данные изомеры реагируют с раствором AgNO3 с образованием разных количеств AgCl: при действии AgNO3 фиолетовое соединение выделяет в осадок весь хлор, светло-зеленое – 2/3, а темно-зеленое – только 1/3 хлора, имеющегося в соединении.
Ионизационная изомерия характерна только для комплексов катионного типа и вызвана различным распределением ионов между внешними и внутренними сферами комплексных соединений и, как следствие этого, различным характером электролитической диссоциации в растворах. Например, для соединения CoBrSO4∙5NH3 известны два изомера: [CoBr(NH3)5]SO4, имеющий красно-фиолетовый цвет и [CoSO4(NH3)5]Br – красного цвета.
Координационная изомерия проявляется в различном распределении лигандов во внутренних координационных сферах комплексов и присуща соединениям, состоящим из комплексного катиона и комплексного аниона, центральные ионы которых различны. Примерами координационных изомеров являются комплексы [Pt(NH3)4]∙[PdCl4] и [Pd(NH3)4]∙[PtCl4], [Co(NH3)6]∙[Cr(CN)6] и [Cr(NH3)6]∙[Co(CN)6] (при взаимодействии с AgNO3 первое соединение дает осадок Ag3[Cr(CN)6], а второе – осадок Ag3[Co(CN)6]) и др. К координационным изомерам относятся также соединения, образованными ионами одного и того же металла, но в разных степенях окисления. Примерами тому могут служить комплексные частицы [PtPy4]∙[PtCl6] и [PtPy4Cl2]∙[PtCl4].
Наряду с координационной изомерией, в химии координационных соединений существует понятие координационной полимерии, отражающее явление, при котором одному и тому же аналитическому составу соединения соответствует несколько веществ, отличающихся молекулярной массой или типом электролитической диссоциации. Например, комплексы [Pt(NH3)2Cl2], [Pt(NH3)3Cl]∙[PtNH3Cl3], [Pt(NH3)3Cl]2∙[PtCl4], [Pt(NH3)4]∙[PtNH3Cl3]2, [Pt(NH3)4]∙[PtСl4] имеют один и тот же аналитический состав Pt(NH3)2Cl2, но их молекулярные массы в 2 – 3 раза превышают молекулярную массу наиболее легкого комплекса. Эти соединения называют координационными полимерами.
Структурная изомерия наблюдается у комплексных частиц, в которых при одинаковых лигандах наблюдается разная конфигурация координационной сферы.
Например, комплекс следующего строения:
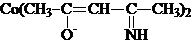
в твердом состоянии имеет плоское строение, а в неводных растворах существует равновесие между плоской и тетраэдрической конфигурацией. Обе конфигурации сильно отличаются по спектральным и магнитным свойствам: плоские комплексы низкоспиновые, а тетраэдрические – высокоспиновые.
Связевая изомерия проявляется у некоторых лигандов, например, у ионов CN–, SCN–, NO2–, имеющих несколько донорных атомов. Координация NO2– возможна как через атом азота, так и через атом кислорода. Комплексы первого типа называются нитро-, а второго – нитритокомплексами. Координация роданида возможна через азот и серу, а координация цианида – через азот и углерод. Такие лиганды называют амбидентатными, а комплексы, отличающиеся только способом присоединения амбидентатного лиганда, называют связевыми изомерами. Наиболее известна связевая нитрито-нитро-изомерия: при реакциях обмена комплексов кобальта(III) с нитрит-ионами вначале получаются нитрито-изомеры (напр., [Co(NH3)5ONO]2+, транс-[Co(NH3)2Py2(ONO)2]+ или цис-[Co(NH3)4(ONO)2]+), имеющие розовую окраску. Со временем как в растворах, так в кристаллическом состоянии они переходят в желто-коричневые нитро-изомеры [Co(NH3)5NO2]2+, транс-[Co(NH3)2Py2(NO2)2]+ или цис-[Co(NH3)4(NO2)2]+.
Геометрическая изомерия состоит в различном пространственном расположении лигандов вокруг центрального иона в координационном полиэдре. Она преимущественно изучена на комплексах с координационным числом 4 (плоскоквадратные) и 6 (октаэдрические).
Например, катион дигидроксотетраамминкобальта(III) [Co(NH3)4(OH)2]+ имеет два изомера:

цис -изомер транс -изомер
Оптическая изомерия характеризуется способностью соединения вращать плоскость поляризации плоскополяризованного света. Два изомера отличаются друг от друга направлением вращения плоскости поляризации: один называют правым, другой – левым изомером. Правые и левые изомеры оказываются зеркальными отображениями друг друга и не могут быть совмещены в пространстве.
Из двух геометрических изомеров диэтилендиаминбромохлороникеля (II) только цис-изомер может существовать в виде двух оптических модификаций. Изомеры такого рода называются энантиомерами:
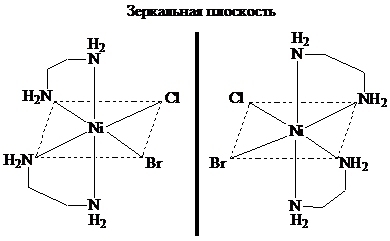
L-изомер D-изомер
 2018-01-21
2018-01-21 3470
3470








