Из уравнения реакции, термодинамических данных и, учитывая, что реакция протекает также и с уменьшением числа молей, увеличение давления благоприятно скажется на равновесном выходе этилового спирта. Для смещения равновесия в сторону гидратации этилена необходимо понижение температуры и повышение давления. Но при температуре ниже 280°С скорость гидратации очень мала, а повышение давления свыше 8МПа повышают себестоимость спирта, что экономически нерентабельно. Также одним из исходных реагентов является перегретый пар, следовательно при таких условиях не удастся избежать конденсации водяного пара. Конденсация воды приводит к снижению активности катализатора вследствие поглощения ее паров фосфорной кислотой с ее последующим разбавлением.
Кинетика процесса
Для обеспечения высокой скорости и селективности процесса используют катализатор. В качестве него применяют фосфорную кислоту, нанесенную на пористый носитель (силикагель или таблетированный синтетический алюмосиликат). Катализатор активен при 280 – 300°С и обладает высокой селективностью. Полезная конверсия этилена при использовании фосфорной кислоты достигает 95%.
Механизм процесса прямой гидратации этилена на данном катализаторе описывается следующими стадиями:
1. Стадия физического растворения этилена в пленке фосфорной кислоты на твердом носителе;
2. Стадия образования этилкарбокатиона
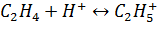
3. Стадия взаимодействия этилкарбокатиона с водой
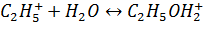
4. Стадия образования спирта и протона
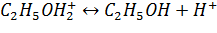
Активность катализатора определяется концентрацией фосфорной кислоты на поверхности носителя. В промышленности берется 83 – 85% кислота.
Катализатор определяет температурный режим процесса. При температуре ниже 280°С скорость процесса небольшая, так как активность фосфорной кислоты мала. При температурах выше 300°С снижается селективность.
 2018-01-21
2018-01-21 782
782








