Химические свойства спиртов.
Спирты отличаются разнообразными превращениями. Реакции спиртов имеют некоторые общие закономерности: реакционная способность первичных одноатомных спиртов выше, чем вторичных, в свою очередь, вторичные спирты химически более активны, чем третичные. Для двухатомных спиртов, в том случае, когда ОН-группы находятся у соседних атомов углерода, наблюдается повышенная (в сравнении с одноатомными спиртами) реакционная способность из-за взаимного влияния этих групп. Для спиртов возможны реакции, проходящие с разрывом как С–О, так и О–Н – связей.
Свойства спиртов
Химические свойства. Различают два основных типа реакций спиртов с участием функциональной группы —ОН:
- реакции с разрывом связи О—Н:
а) взаимодействие спиртов с щелочными и щелочноземельными металлами с образованием алкоксидов;
б) реакция спиртов с органическими и минеральными кислотами с образованием сложных эфиров;
в) окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений. Скорость реакций, при которых разрывается связь О—Н, уменьшается в ряду:
|
|
|
первичные спирты > вторичные > третичные.
- Реакции, сопровождающиеся разрывом связи С—О:
а) каталитическая дегидратация с образованием алкенов (внутримолекулярная дегидратация) или простых эфиров (межмолекулярная дегидратация);
б) замещение группы —ОН галогеном, например при действии галогеноводородов с образованием алкилгалогенидов.
Скорость реакций, при которых разрывается связь С—О, уменьшается в ряду:
третичные спирты > вторичные > первичные.
Спирты являются амфотерными соединениями.
1. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют с щелочными металлами:

С увеличением длины углеводородного радикала скорость этой реакции замедляется.
В присутствии следов влаги образующиеся алкоголяты разлагаются до исходных спиртов:

Это доказывает, что спирты — более слабые кислоты, чем вода.
2. Слабые основные свойства спиртов обусловлены наличием неподеленной электронной пары на атоме кислорода и проявляются в обратимых реакциях с галогеноводородами:


Положение равновесия зависит от соотношения реагентов.
3. Образование сложных эфиров протекает по механизму нуклеофильного присоединения-отщепления:


В качестве нуклеофила выступает молекула спирта, атакующая атом углерода карбоксильной группы, несущий частичный положительный заряд. Отличительной особенностью этой реакции является то, что замещение протекает у атома углерода, находящегося в состоянии sp2-гибридизации.
4. Межмолекулярная дегидратация спиртов. При нагревании спирта в присутствии каталитических количеств сильной кислоты происходит отщепление молекулы воды от двух молекул спирта и образуется простой эфир:
|
|
|

Простые эфиры — это органические вещества, молекулы которых состоят из углеводородных радикалов, соединенных атомом кислорода: R'—О—R", где R' и R" — радикалы, которые могут быть различными или одинаковыми.
Диэтиловый, или серный, эфир — хороший растворитель многих органических веществ, применяется для чистки тканей, а в медицине — при хирургических операциях, так как обладает анестезирующим действием.
5. Реакция элиминирования, или внутримолекулярной дегидратации (см. “Алкены”). Конкурентная реакции 4) (см. предыдущую реакцию), реакция 5) становится преобладающей при использовании больших количеств кислоты:

6. Реакции окисления. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты:
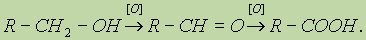
Вторичные спирты окисляются в кетоны:

Третичные спирты более устойчивы к окислению. При действии на них сильных окислителей может происходить расщепление углеродного скелета молекулы третичного спирта с образованием карбоновых кислот и кетонов с меньшим числом углеродных атомов, чем в молекуле исходного третичного спирта. Окисление обычно проводят дихроматом или перманганатом калия с серной кислотой.
Многоатомные спирты. Двух- и трехатомные спирты получают теми же способами, что и одноатомные. В качестве исходных соединений могут быть использованы алкены, галогенопроизводные и другие соединения.
Общим методом синтеза гликолей является окисление алкенов перманганатом калия в нейтральной или щелочной среде.
Для двух- и трехатомных спиртов характерны основные реакции одноатомных спиртов. Однако вих химических свойствах есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп.
Кислотность многоатомных спиртов выше, чем одноатомных, что объясняется наличием в молекуле дополнительных гидроксильных групп, обладающих отрицательным индуктивным эффектом. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют с щелочами, образуя соли. По аналогии с алкоголятами соли двухатомных спиртов называют гликолятами, а трехатомных — глицератами.
При взаимодействии гидроксида меди (II) с глицерином и другими многоатомными спиртами происходит растворение гидроксида и образуется комплексное соединение синего цвета. Эта реакция используется для обнаружения многоатомных спиртов, имеющих гидроксильные группы при соседних атомах углерода —СН(ОН)—СН(ОН)—:

Для многоатомных спиртов характерно образование сложных эфиров. В частности, при реакции глицерина с азотной кислотой в присутствии каталитических количеств серной кислоты образуется тринитрат глицерина (нитроглицерин):

Химические свойства одно-, двух- и трёхатомных фенолов, кислотно-основные, электрофильные: С-алкилирование, С-ацетилирование, окисление, восстановление. Напишите уравнения реакций.
Химические свойства. В фенолах р-орбиталь атома кислорода образует с ароматическим кольцом единую -систему. Вследствие такого взаимодействия электронная плотность у атома кислорода уменьшается, а в бензольном кольце повышается. Полярность связи О—Н увеличивается, и водород ОН-группы становится более реакционноспособным и легко замещается на металл даже при действии щелочей (в отличие от предельных одноатомных спиртов).
Кроме того, в результате такого взаимного влияния в молекуле фенола увеличивается реакционная способность бензольного кольца в орто- и пара -положениях в реакциях электрофильного замещения (галогенирования, нитрования, поликонденсапии и т. д.):
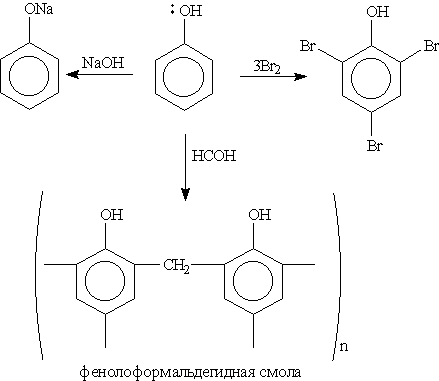
1. Кислотные свойства фенола проявляются в реакциях со щелочами (сохранилось старинное название “карболовая кислота”):
|
|
|

Фенол, однако, является очень слабой кислотой. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол — такая реакция доказывает, что фенол — более слабая кислота, чем угольная и сернистая:

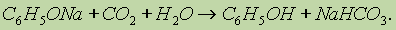
Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются при введении заместителей II рода.
2. Образование сложных эфиров. В отличие от спиртов фонолы не образуют сложных эфиров при действии на них карбоновых кислот; для этого используются хлорангидриды кислот:

3. Галогенирование. При действии на фенол бромной воды образуется осадок 2,4,6-трибромфенола:
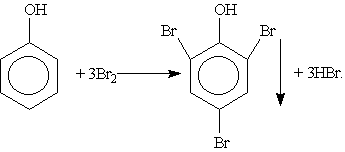
Это — качественная реакция для обнаружения фенола.
4. Нитрование. Под действием 20% -ной азотной кислоты фенол легко превращается в смесь орто- и пара- нитрофенолов. Если нитровать фенол концентрированной азотной кислотой, то образуется 2,4,6-тринитрофенол — сильная кислота (пикриновая).
5. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха. Так, при стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет. При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона образуется хинон:

ИЛИ
 2018-01-21
2018-01-21 3371
3371
