Основой расчета изменения энтропииявляется уравнение (3.20), в которое нужно подставлять значения d Q соответствующего процесса. В соответствии с ранее полученными уравнениями (2.18) и (2.24) изменения энтропии равны:
dS = dQ/Т = l dV/Т + с V dT/Т; (3.26)
dS = dQ / Т = h dp / Т + cp dT/Т, (3.27)
или для конечного процесса:
 , (3.28)
, (3.28)
 . (3.29)
. (3.29)
Точное решение этих уравнений возможно лишь при известных значениях l и h и температурной зависимости теплоемкости. Рассмотрим некоторые частные случаи расчета изменения энтропии.
Нагревание при постоянном объеме или постоянном давлении. В соответствии с (3.28) или (3.29):
 или
или 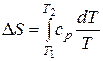 . (3.30)
. (3.30)
В небольшом температурном интервале можно считать теплоемкости постоянными. Тогда
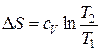 или
или 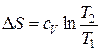 . (3.31)
. (3.31)
Изотермическое расширение идеального газа. Как следует из определения калорических коэффициентов, для идеального газа, внутренняя энергия которого зависит только от температуры, l = p и h = – V (см. разд. 2.3). Тогда из уравнений (3.26) и (3.27) с использованием уравнения состояния идеального газа получим:
 или
или  . (3.32)
. (3.32)
Смешение двух идеальных газов при постоянных температуре и давлении. Если смешивать n 1 и n 2 молей идеальных газов, занимающих объемы V 1 и V 2, общее изменение энтропии равно сумме изменений энтропий каждого из газов вследствие изменения объемов от первоначального до общего V 1 + V 2:
 . (3.33)
. (3.33)
Фазовые превращения. Фазовые (агрегатные) превращения (плавление, испарение, переход из одной кристаллической модификации в другую и т.п.) происходят при постоянных температуре и давлении. Теплота такого перехода равна изменению энтальпии при фазовом превращении D H ф.п., поэтому
 . (3.34)
. (3.34)
Необратимые процессы. Для необратимых процессов dS >d Q. В этом случае необходимо представить необратимый процесс в виде последовательности каких-либо обратимых процессов, переводящих систему из исходного состояния 1 в конечное 2. Так как энтропия является функцией состояния, то ее изменение в необратимом процессе будет равно сумме изменений энтропий в обратимых процессах.
Рассмотрим, например, изменение энтропии при затвердевании моля переохлажденной жидкости, находящейся при температуре T, более низкой, чем температура плавления T пл:
жидкость (T) ® кристаллы (T) D S =?
Этот переход можно заменить совокупностью следующих процессов:
1. Обратимое нагревание жидкости до температуры плавления, для которого
 ;
;
2. Кристаллизация жидкости при температуре T пл:
 ;
;
3. Обратимое охлаждение твердого вещества до температуры T:
 .
.
Общее изменение энтропии
D S =D S 1 + D S 2 + D S 3.
Химические реакции в обычных условиях являются неравновесными (необратимыми). Например, реакция
Н2(газ) + 1/2О2(газ) = Н2О(жидк.)
проходит при комнатной температуре (хотя и очень медленно в отсутствие катализатора). Тепловой эффект реакции при 298 К и постоянном давлении равен –285,83 кДж/моль. Чтобы рассчитать изменение энтропии, необходимо провести реакции в тех же условиях обратимо. Это возможно сделать с помощью гальванического элемента. При работе такого элемента выделяется 48,65 кДж/моль тепла. Следовательно, изменение энтропии в этой реакции равно
 Дж.моль–1.К–1.
Дж.моль–1.К–1.
При необратимом протекании реакции тепло, которое выделяется, поглощается внешней средой, изменение энтропии которой равняется:
 Дж.моль–1.К–1.
Дж.моль–1.К–1.
Таким образом, общее изменение энтропии системы, которую можно рассматривать в целом как изолированную, будет равно
D S = D S внутр.+ D S внешн. = –163,2 + 958,7 = 795,5 Дж.моль–1.К–1.
 2017-11-01
2017-11-01 731
731








