 Рис. 3.3. Цикл Карно для насыщенного пара Рис. 3.3. Цикл Карно для насыщенного пара |
В рассмотренном цикле Карно рабочим телом является идеальный газ. Идеальный газ можно заменить другим рабочим веществом, например, насыщенным водяным паром. В таком случае также можно осуществить цикл из двух изотерм и двух адиабат, при этом изотермы будут одновременно и изобарами (рис. 3.3). Изотерма АВ соответствует испарению воды, а изотерма СD – конденсации пара. Однако выражение (3.2) для к.п.д. остается справедливым и в этом случае.
Предположим, что оба цикла (с идеальным газом и водяным паром) функционируют обратимо при тех же температурах холодильников (Т 2) и нагревателей (T 1) и получают одинаковое количество тепла  от нагревателей. Пусть одна машина работает в прямом направлении, производя работу, а другая – в обратном, передавая тепло от холодильника к нагревателю и затрачивая некоторую работу.
от нагревателей. Пусть одна машина работает в прямом направлении, производя работу, а другая – в обратном, передавая тепло от холодильника к нагревателю и затрачивая некоторую работу.
Свяжем обе машины между собой. Если циклы не эквивалентны (например, к.п.д. прямого цикла больше), работа, произведенная одним, будет больше работы, затраченной другим:
 , (3.10)
, (3.10)
т.е.
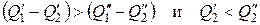 . (3.11)
. (3.11)
В целом вся система совершит некоторую работу. Но система не извлекает тепла из нагревателя, так как одна из машин возвращает источнику все тепло, полученное другой. Таким образом, вся работа производится вследствие теплообмена с единственным источником – холодильником, что противоречит второму закону термодинамики. Полная работа должна быть равна нулю, равенство двух теплот Q влечет необходимость равенства
 и к.п.д.
и к.п.д. 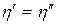 . (3.12)
. (3.12)
Таким образом, к.п.д. машины, обратимо работающей по циклу Карно, не зависит от природы рабочего тела (первая теорема Карно – Клаузиуса).
Сравним обратимый цикл Карно с циклом, в котором хотя бы один из процессов необратим. Природа рабочего тела и температуры источников в обоих случаях одинаковы. Пусть работа, совершаемая необратимой машиной, затрачивается на приведение в действие обратимой машины, работающей в обратном направлении. Примем, что количество тепла, получаемое от нагревателя первой машиной, равно количеству тепла, которое передается нагревателю машиной, работающей по обратимому циклу. В этом случае полный теплообмен между нагревателем и системой из двух машин, равен нулю, и система не может производить положительную работу ибо в противном случае она представляла бы собой вечный двигатель второго рода.
Полная работа может быть равна нулю только при условии, что тепло, отобранное от холодильника в обратном цикле, равно теплу, переданному холодильнику в прямом цикле. Но в этом случае обратимый цикл должен подвергаться всем изменениям, связанным с необратимостью другого цикла, что противоречит нашим первоначальным условиям. Значит, количество тепла, переданное в необратимом цикле холодильнику, по абсолютному значению может быть только больше количества тепла, полученного в обратимом цикле, т.е. к.п.д. необратимого цикла Карно меньше к.п.д. обратимого цикла.
Сказанное выше можно отнести к любому циклу. Рассмотрим произвольный цикл авсd (рис.3.4). Его можно представить бесконечно большим количеством бесконечно малых циклов Карно, каждый из которых состоит из двух бесконечно малых отрезков изотерм  = (Т 1 – D Т 1) и
= (Т 1 – D Т 1) и  = (Т 2 + D Т 2) и конечных отрезков адиабат.
= (Т 2 + D Т 2) и конечных отрезков адиабат.
Суммарная площадь всех элементарных циклов Карно на бесконечно малую величину меньше площади цикла abcd. К.п.д. каждого элементарного цикла
 , (3.13)
, (3.13)
 Рис. 3.4. Разбиение произвольного цикла на элементарные циклы Карно Рис. 3.4. Разбиение произвольного цикла на элементарные циклы Карно |
и средний к.п.д. любого цикла меньше к.п.д. цикла Карно в том же интервале температур T – T. Следовательно, к.п.д. любого цикла меньше к.п.д. цикла Карно между теми же температурами (теорема Карно).
Обобщая сказанное, можно записать выражение для к.п.д. любого цикла:
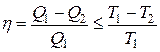 , (3.14)
, (3.14)
где знак равенства относится к обратимому циклу Карно, а знак неравенства – ко всем остальным циклам.
Энтропия.
Из уравнения (3.14) следует, что для цикла алгебраическая сумма (учитывая условие о знаках в термодинамике)
Q 1/ Т 1 + Q 2/ Т 2 £ 0, (3.15)
где Q/T называется " приведенной теплотой ".
Таким образом, сумма приведенных теплот равна нулю в обратимом цикле и меньше нуля в необратимом. Для бесконечно малых циклов также можно записать:
dQ 1/ Т 1 + dQ 2/ Т 2 £ 0, (3.16)
Суммируя эти значения всех бесконечно малых циклов, в целом для конечного цикла получим:
lim S dQ / Т =  £ 0. (3.17)
£ 0. (3.17)
Рассмотрим обратимый переход системы из состояния 1 в состояние 2 двумя путями a и b. Для цикла 1 a 2 b 1 в соответствии с (3.8)
 |
 . (3.18)
. (3.18)
Отсюда следует:
 . (3.19)
. (3.19)
Из (3.18) видно, что значение  не зависит от пути процесса, т.е. существует некоторая функция состояния S, изменение которой
не зависит от пути процесса, т.е. существует некоторая функция состояния S, изменение которой
dS = dQ об/ Т или D S = S 2 – S 1 =  . (3.20)
. (3.20)
Если хотя бы один из процессов в цикле необратим (например, переход из 1 в 2 по пути a), цикл в целом также является необратимым, и тогда
 +
+  < 0, или
< 0, или  <
<  , (3.21)
, (3.21)
т.е.
dS > dQ необ/ Т или D S >  . (3.22)
. (3.22)
Неравенства (3.9) не означают, что при переходе из 1 в 2 необратимым путем изменения энтропии будут отличаться от dS в обратимом переходе. так как энтропия является функцией состояния, то ее изменения зависят только от начального и конечного состояний системы, но значения приведенных теплот dQ / Т зависят от характера процесса. Таким образом, в общем случае
dS ³ dQ / Т и D S ³  . (3.23)
. (3.23)
Уравнения (3.23) можно рассматривать как одну из форм аналитического выражения второго закона термодинамики.
Рассмотрим изолированную систему, для которой d Q = 0. Такая система может находиться в равновесии, или в ней могут протекать только самопроизвольные процессы. Исходя из (3.23), для изолированной системы получим: dS ³ 0. На практике в качестве изолированной можно рассматривать изучаемую систему вместе с окружающей средой достаточно большого размера, так что ее температура остается постоянной, а обмен теплом между изучаемой системой и средой представить как обратимый изотермический процесс. Если S – энтропия системы, в которой происходят изменения, а S вн – энтропия окружающей среды, элементарное изменение энтропии равно (dS + dS вн) и можно написать:
для обратимых процессов (dS + dS вн) = 0. (3.24)
для необратимых процессов (dS + dS вн) > 0 (3.25)
Таким образом, изменения энтропии в изолированной системе указывают на возможность самопроизвольных переходов в системе (увеличение энтропии) или на состояние равновесия (постоянство энтропии).
 2017-11-01
2017-11-01 3057
3057
