Рассмотренные выше соотношения дают возможность рассчитать только изменения энтропии, но не позволяют найти ее абсолютное значение. Энтропию можно вычислить на основании постулата Планка (1912), согласно которому энтропия идеального кристалла индивидуального вещества равна нулю при абсолютном нуле температуры
S о = 0. (3.35)
Этот постулат называют также третьим законом термодинамики в формулировке Планка.
Для реальных тел возможны нарушения кристаллической решетки, в связи с чем энтропия твердого тела даже при абсолютном нуле будет больше нуля. Однако эти отличия невелики, и с достаточной для практических расчетов точностью можно считать энтропию равной нулю.
Постулат Планка используется для расчета абсолютных энтропий химических соединений. Для этого необходимо знать теплоемкость вещества, начиная с возможно более низких температур, а также теплоты агрегатных превращений. Изменение энтропии вещества при переходе от нуля до некоторой температуры T равно D S = SТ – S о, но поскольку S о = 0, то SТ = D S, и задача определения S сводится к расчету изменений энтропии, которые можно определить, используя уравнения (3.31) – (3.34).
В справочных таблицах термодинамических свойств веществ обычно приводится величина 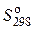 – стандартная энтропия при 298 К и p = 1,013.105 Па. Для нахождения абсолютных энтропий в других условиях необходимо к этим значениям прибавить изменения, связанные с переходом из стандартного состояния в новое.
– стандартная энтропия при 298 К и p = 1,013.105 Па. Для нахождения абсолютных энтропий в других условиях необходимо к этим значениям прибавить изменения, связанные с переходом из стандартного состояния в новое.
 2017-11-01
2017-11-01 405
405








