Ще одна характерна відмінність еукаріотичної хромосоми полягає в тому, що вона, на відміну від прокаріотичної, є лінійною – має два кінці. Унаслідок цієї простої обставини на 3′-кінцях матричних ланцюгів ДНК залишаються одноланцюгові хвости (рис. 21): два РНК-праймери на 5′-кінцях синтезованих ланцюгів видаляються, а прогалина не може бути заповненою, оскільки немає 3′-кінця, який міг би бути використаним як праймер. Одноланцюгові хвости піддаються швидкій нуклеазній деградації і після кожної реплікації хромосома має вкоротитися.
Кінцеві ділянки ДНК еукаріотичної хромосоми – теломери – складаються з невеликих елементів послідовності, що тандемно повторюються – теломерних повторів. Подовження теломер після реплікації здійснюється за допомогою спеціального ферменту – теломерази, яка є РНК-залежною-ДНК-полімеразою. РНК-матриця входить до складу самого ферменту і містить ділянку, комплементарну теломерному повтору (рис. 22). Використовуючи цю ділянку як матрицю і 3′-кінець як праймер, теломераза покроково добудовує до 3′-кінця кілька копій теломеразного повтору. Далі подовжений одноланцюговий хвіст використовується як матриця для синтезу іншого ланцюга за звичайним реплікативним механізмом. Видалення РНК-праймера після цього не є проблемою, оскільки хромосома вже є подовженою.

Рис. 21. Дві дочірні лінійні молекули ДНК після реплікації.

Рис. 22. Подовження кінців хромосоми за допомогою теломерази.
Теломераза є активною в клітинах, що розвиваються, і злоякісно-трансформованих клітинах і неактивною – у диференційованих соматичних клітинах вищих еукаріотів. Відповідно, певне критичне скорочення теломерів, яке відбувається в таких клітинах після кількох десятків клітинних поділів, є одним із механізмів активації програми їхньої загибелі.
Репарація ДНК
Репарація (repair) ДНК – один із загальних біологічних процесів, який спрямований на виправлення помилок синтезу ДНК при реплікації, а також численних пошкоджень, котрі виникають у ДНК унаслідок дії хімічних і фізичних факторів. До таких пошкоджень відносять різноманітні хімічні модифікації азотистих основ, ковалентні зшивки сусідніх піримідинів (утворення піримідинових, найчастіше тимінових, димерів) під дією ультрафіолетового випромінювання, одно- і дволоанцюгові розриви під дією іонізуючої радіації та вільних радикалів тощо. Часто системи репарації працюють під час або відразу після реплікації. Більшість репараційних процесів передбачає видалення пошкодженої одноланцюгової ділянки з наступним синтезом ДНК за допомогою ДНК-полімераз. Але існують і процеси, пов’язані з безпосереднім «виправленням» пошкодженого елемента за рахунок прямої дії певних ферментів.
Пряма репарація
Найочевиднішим випадком прямої репарації є зшивання одноланцюгового розриву ДНК лігазою. Іншим спільним для всіх живих організмів (за винятком ссавців) шляхом прямої репараціїє фотореактивація – руйнування піримідинових димерів (рис. 23), які були індуковані ультрафіолетовим світлом, ферментом фотоліазою. Фотоліаза (або її власні амінокислотні залишки, або зв’язані з білком простетичні групи) здатна поглинати світло, що призводить до активації ферменту. Тобто світло, яке викликає утворення піримідинових димерів, одночасно активує фотоліазу, котра каталізує розрив ковалентних зв’язків між сусідніми піримідинами (рис. 23), а отже, відновлення структури ДНК.
Одним із загальних пошкоджуючих впливів на ДНК є алкілування азотистих основ – ковалентне приєднання метильних чи етильних груп до атомів О або N. Пряма репарація таких пошкоджень є можливою за рахунок активності специфічних метилтрансфераз, що відщеплюють метильні групи (таким шляхом репаруються О6-метилгуанін та О4-метилтимін). Ці метилтрансферази не є ферментами: вони відщеплюють метильну групу й необернено ковалентно приєднують її до залишку Cys у своєму активному центрі – для нового акту деметилювання необхідна нова молекула білка.
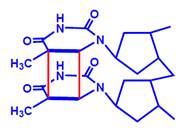
Рис. 23. Тиміновий димер.
Ексцизійна репарація
Більш радикальним і ефективним шляхом виправлення порушень нуклеотидів є ексцизійна репарація (excision repair), коли пошкоджена одноланцюгова ділянка вирізається з ДНК, а інший ланцюг використовується далі як матриця для нового синтезу. Існує два варіантитакої репарації.
При ексцизійній репарації азотистих основ (Base Excision Repair –BER), що відбувається в усіх організмів, модифікована азотиста основа видаляється ферментом глікозилазою. Існує певна кількість специфічних глікозилаз, що розпізнають різноманітні модифіковані основи. Глікозилаза руйнує глікозидний зв’язок між основою та С1-атомом дезоксирибози (рис. 24). У ДНК залишається так званий АП-сайт (апуриновий / апіримідиновий), який упізнається ендонуклеазою, що гідролізує фосфодіефірний зв’язок між 5′-фосфатом звільненої від основи дезоксирибози та попереднім нуклеотидом. Нарешті фосфодіестераза відщеплює цю фосфодезоксирибозу, і в ДНК залишається прогалина довжиною в один нуклеотид. Ця прогалина заповнюється ДНК-полімеразою β (в еукаріотів), яка приєднує нуклеотид до 3′ ОН-групи попереднього нуклеотиду ланцюга. Фосфодіефірний зв’язок приєднаного нуклеотиду з наступним нуклеотидом ланцюга відновлюється лігазою.
У прокаріотів заповнення прогалини здійснюється ДНК-полімеразою І. При цьому, за рахунок своєї 5′-екзонуклеазної активності, полімераза може руйнувати певну ділянку з 5′-кінця прогалини, одночасно продовжуючи 3′-кінець.

Рис. 24. Ексцизійна репарація азотистих основ. Пошкоджена основа забарвлена червоним.
Ексцизійна репарація нуклеотидів (Nucleotide Excision Repair – NER) – процес, пов’язаний із вирізанням ділянки ДНК, яка містить пошкодження (модифіковану основу, тиміновий димер тощо).
У клітинах E. coli за цей шлях відповідає система uvrABC (uvr – ultraviolet repair). Комплекс білка uvrB і двох білків uvrA впізнає пошкодження та зв’язується з ДНК у цьому місці (рис. 25). На наступному кроці відбувається АТР-залежна зміна конформації uvrB, вигин ДНК і дисоціація uvrA. До комплексу рекрутується білок uvrС. Обидва білки у складі комплексу набувають ендонуклеазної активності: uvrС робить одноланцюговий розріз у пошкодженому ланцюзі за кілька нуклеотидів у напрямку до 5′-кінця від пошкодження (ліворуч на рис. 25); uvrB – розріз з іншого боку від пошкодження. Довжина ділянки між розрізами дорівнює 12 (або 13 у випадку для тимінового димеру) нуклеотидам. Далі геліказа uvrD руйнує подвійну спіраль між двома розрізами, тобто видаляє пошкоджену ділянку.
Прогалина, що залишилася, заповнюється ДНК-полімеразою І, лігаза остаточно відновлює цілісність ланцюга.
Аналогічна система ексцизійної репарації працює в еукаріотичних клітинах. До неї залучено близько 17 білків, причому за руйнування подвійної спіралі відповідає геліказна частина загального фактора транскрипції TFIIH. Це забезпечує тісну координацію репарації з транскрипцією: і підвищена ймовірність пошкоджень, і першочергова необхідність виправляти їх виникає насамперед у транскрипційно активних ділянках. Пошкодження розпізнаються або особливими білковими факторами, або РНК-полімеразою, яка робить зупинку на пошкодженому нуклеотиді. Після цього геліказа руйнує ділянку подвійної спіралі довжиною 24 – 32 пари основ, пошкоджена ділянка вирізається ендонуклеазами, і прогалина заповнюється ДНК-полімеразами δ/ε.
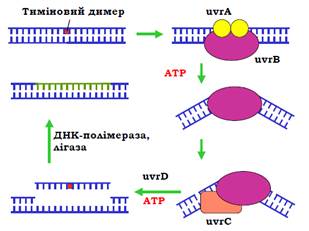
Рис. 25. Система uvrABC ексцизійної репарації нуклеотидів у E. Coli.
 2017-11-01
2017-11-01 562
562








