3.1. Цель работы
Выполнение калориметрических измерений и термодинамических расчетов, связанных с энергетикой химических реакций.
3.2. Объекты и средства исследования: калориметр, термометр, мешалка с электроприводом, коническая воронка, 1М растворы хлористоводородной кислоты и гидроксида натрия.
3.3. Программа работы.
3.3.1. Взвесить сухой калориметрический стакан (с точностью до 0,1 г).
3.3.2.Собрать калориметрическую установку (рис.1) и через воронку налить в сосуд 75 мл 1М раствора щелочи; записать температуру раствора щелочи Тщ с точностью до 0,1 К.

3.3.3. Налить в мерный цилиндр такой же объем 1М раствора кислоты и измерить температуру раствора Тк с той же точностью. Начальная температура смеси кислоты и щелочи Т1 – среднее арифметическое от Тщ и Тк.
3.3.4. При работающей мешалке через воронку быстро влить кислоту в калориметрический стакан и отметить самую высокую температуру Т2, которую покажет термометр после сливания растворов.
3.3.5. Данные опыта свести в таблицу 1.
Таблица 1.
| Масса калоримет- рического стакана, m1, г | Суммарный объем жидкости в стакане, V, мл | Температура, К | |||
| Тщ | Тк | Т1 | Т2 | ||
3.3.6. По полученным данным определить:
а) разницу температур (Т2 –Т1)
б) массу жидкости в калориметрическом стакане, m2 (при расчете считать плотность жидкости равной единице)
в) теплоемкость системы
 где
где
с1 = 0,75.103 Дж/кг×К – удельная теплоемкость стекла,
с2 = 4,18. 103 Дж/кг×К – удельная теплоемкость раствора.
г) количество теплоты, выделившееся при реакции:

д) число моль нейтрализованной кислоты (щелочи) или число моль полученной воды (n)
е) теплоту нейтрализации 

 (кДж/моль H2O)
(кДж/моль H2O)
3.3.7. Используя справочные данные, рассчитать теоретическое значение теплоты реакции (ΔH0теор)
 ,
,
и относительную ошибку эксперимента, которая не должна превышать 5%.
3.4. Контрольные вопросы
Установить термодинамическую возможность протекания химического процесса при стандартном состоянии и область температур, при которых протекание химической реакции возможно. Для решения используйте таблицу термодинамических функций веществ.
1. 
2. 

3. 
4. 
5. 
6. 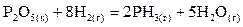
7. 
8. 
9. 
10. 
11. 
12. 
13. 
14. 
15. 
16. 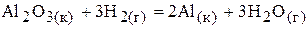
17. 
18. 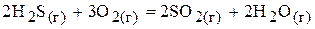
19. 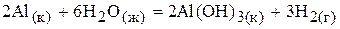
20. 
21. 
22. 
23. 
24. 
25. 
26. 
27. 
28. 
29. 
30. 
31. 
32. 
33. 
34. 
35. 
36. 
37. 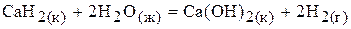
38. 
39. 
40. 
41. 
42. 
43. 
44. 
45. 
46. 
47. 
48. 
49. 
50. 
51. 
52. 
53. 
54. 
55. 
56. 
57. 
58. 
59. 
60. 
61. 
62. 
63. 
64. 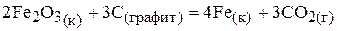
65. 
66. 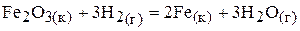
67. 
68. 
69. 
70. 
71. 
72. 
73. 
74. 
75. 
76. 
77. 
78. 
79. 
80. 
81. 
82. 
83. 
84. 
85. 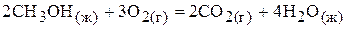
86. 
87. 
88. 
89. 
90. 
Таблица 2.
Стандартные энтальпии образования (ΔН0298) и энтропии (S0298)
некоторых веществ
| Вещество | ΔН0298,  | S0298,  | Вещество | ΔН0298,  | S0298,  | |
| Ag(к) | 42,55 | KClO4(к) | -414,80 | 146,60 | ||
| AgNO3(к) | -124,50 | 140,90 | KCl(к) | -435,90 | 82,60 | |
| Al (к) | 27,30 | Mg(к) | 28,20 | |||
| Al2O3 (к) | -1672,00 | 50,90 | Mg(OH)2(к) | -885,60 | 60,90 | |
| AlF3 (к) | -1422,70 | 63,10 | MgCl2(к) | -641,10 | 89,90 | |
| Al4C3(к) | -209,00 | 88,95 | MgCO3(к) | -1060,00 | 63,40 | |
| Al(OH)3(к) | -1237,90 | 81,00 | Mg3N2(к) | -461,10 | 87,90 | |
| BaO2(к) | -629,70 | 65,70 | MgO(к) | -601,80 | 26,90 | |
| BaSO4(к) | -1465,00 | 132,00 | MnO2(к) | -498,20 | 51,40 | |
| С(графит) | 5,70 | Mn(к) | 30,80 | |||
| CH4(г) | -74,86 | 186,19 | N2(г) | 191,50 | ||
| С2Н2 (г) | 226,80 | 200,80 | NH3(г) | -46,20 | 192,60 | |
| С6Н6(ж) | 82,60 | 269,20 | NH4NO2(к) | -256,00 | 116,80 | |
| С6Н5NO2(ж) | 16,00 | 225,10 | NH4NO3(к) | -365,40 | 151,00 | |
| С2Н4 (г) | 52,30 | 219,45 | N2O(г) | 82,00 | 219,90 | |
| CH3OH(ж) | -238,57 | 126,78 | NO(г) | 90,30 | 210,60 | |
| C2H5OH(ж) | -277,60 | 160,70 | NO2(г) | 33,50 | 240,20 | |
| CO(г) | -110,50 | 197,50 | N2O4(г) | 9,60 | 303,80 | |
| СО2(г) | -393,50 | 213,70 | (NH4)2SO4(к) | -1183,90 | 220,90 | |
| СОСl2(г) | -214,20 | 281,00 | NH4Cl(к) | -314,20 | 95,80 | |
| CaCO3(к) | -1207,00 | 88,70 | NaAlO2(к) | -1137,40 | 67,60 | |
| СаН2(к) | -182,40 | 42,10 | Na2O2(к) | -492,8 | 91,90 | |
| Са3N2(к) | -431,80 | 105,00 | Na3AlF6(к) | -3059,20 | 228,40 | |
| СаО(к) | -635,50 | 39,70 | NaCl(к) | -394,80 | 69,80 | |
| СаС2(к) | -57,60 | 67,80 | NaClO3(к) | -365,40 | 129,70 | |
| Са(ОН)2(к) | -986,60 | 76,10 | NaF(к) | -546,80 | 49,40 | |
| Са3(РО4)2(к) | -4142,00 | 231,60 | Na2CO3(к) | -1086,80 | 130,40 | |
| CaSiO3(к) | -1599,90 | 83,90 | Na2SiF6(к) | -2724,60 | 205,60 | |
| СaSO4(к) | -1338,00 | 102,40 | Na2SO4(к) | -1342,40 | 143,20 | |
| Cl2(г) | 222,90 | NaOH(к) | -409,80 | 62,20 | ||
| Сu(к) | 32,10 | Ni(к) | 29,90 | |||
| CuO(к) | -149,60 | 41,20 | Ni(CO)4(ж) | -579,40 | 384,50 | |
| Cu(OH)2(к) | -450,20 | 80,40 | О2(г) | 205,00 | ||
| СuS(к) | -49,60 | 41,30 | ОН-(р) | -230,19 | 10,86 | |
| CuSO4(к) | -753,00 | 101,80 | Р2О5(к) | -1492,00 | 114,50 | |
| Cr(OH)3(к) | -999,98 | 80,33 | PCl5(ж) | -443,40 | 302,90 | |
| Cr2O3(к) | -1140,60 | 81,20 | Н3РО4(ж) | -1212,00 | 106,20 | |
| Cr(к) | 23,60 | РН3(г) | 16,80 | 202,30 | ||
| Fe(к) | 26,80 | РbO(к) | -219,30 | 66,10 | ||
| FeO(к) | -264,80 | 60,80 | Pb(NO3)2(к) | -429,80 | 204,10 | |
| Fe2O3(к) | -812,20 | 87,40 | PbSO4(к) | -878,50 | 21,20 | |
| Fe3O4(к) | -1117,10 | 146,2 | PbO2(к) | -276,60 | 74,90 | |
| FeS (к) | -100,40 | 60,30 | S(к) | 30,70 | ||
| FeSО4 (к) | -929,50 | 121,00 | SO2(г) | -296,96 | 248,10 | |
| Fe(CrO2)2(к) | -5,30 | 140,40 | SO3(г) | -395,80 | 256,70 | |
| Fe(TiO3)3(к) | -1239,00 | 102,20 | SiF4(г) | -1614,90 | 282,60 | |
| FeCO3(к) | -738,15 | 95,40 | SiCl4(ж) | -687,80 | 239,70 | |
| H2(г) | 130,50 | SiH4(г) | 34,70 | 204,60 | ||
| H+(р) | SiO2(к) | -910,00 | 41,80 | |||
| HCl(г) | -270,70 | 206,50 | Sn(к) | 51,60 | ||
| Н2О(г) | -241,80 | 188,60 | SnО(к) | -286,00 | 56,50 | |
| Н2О(ж) | -285,80 | 70,10 | SnCl4(ж) | -421,70 | 247,60 | |
| Н2О2(ж) | -187,80 | 109,5 | Ti(к) | 30,60 | ||
| H2S(г) | -210,80 | 205,70 | TiCl4(ж) | -804,20 | 252,40 | |
| HNO2(ж) | -79,80 | 247,30 | TiO2(к) | -943,70 | 50,30 | |
| HNO3(ж) | -129,20 | 253,10 | ZnSO4(к) | -936,50 | 123,80 | |
| Н2SO4(ж) | -814,20 | 156,90 | ZnO(к) | -350,60 | 43,60 | |
| Н2SnO3(к) | -992,20 | 83,60 | ZnS(к) | -193,20 | 45,70 | |
| KClO3(к) | -391,20 | Zn(NO3)2(к) | -456,90 | 185,50 |
Лабораторная работа № 4
 2017-11-01
2017-11-01 1050
1050








