| Адсорбенты | Диаметр пор*, нм | Удельная поверхность, м2/кг |
| Непористые | - | 1 - 500 |
| Макропористые | > 4,0 | (0,5 - 2,0)103 |
| Мезопористые | 1,2 - 4,0 | < 4• 105 |
| Микропористые | <1,2 | 4 •105 (объем не более 0,5•10-3м3/кг) |
2.1. Адсорбция газов
Адсорбция газов на микро- и мезопористых адсорбентах существенным образом отличается от их адсорбции на непористых и макропористых адсорбентах. Адсорбция на микропористых адсорбентах заключается в объемном заполнении пространства пор, а адсорбция на мезопористых адсорбентах — в капиллярной конденсации паров адсорбата. Адсорбционная емкость микропор определяется не только их удельной поверхностью, но и объемом самих микропор.
Для непористых и макропористых адсорбентов наблюдается мономолекулярная и полимолекулярная адсорбция. В случае порошкообразных адсорбентов различие между ними обусловлено лишь величиной удельной поверхности.
2.2. Адсорбция жидкости
Адсорбция на поверхности твердого тела, граничащего с жидкостью, в зависимости от природы адсорбтива и адсорбента и механизма процесса может быть молекулярной, ионной и ионообменной.
Молекулярная адсорбция осуществляется из растворов, а адсорбтивом являются молекулы растворенного вещества. К разновидностям молекулярной адсорбции относится адсорбция ПАВ.
Адсорбция ПАВ на границе раздела твердое тело - жидкость имеет много общего с адсорбцией ПАВ на границе жидкости с газом, но характеризуется некоторыми особенностями. Общность заключается в том, что уравнения Генри, Фрейндлиха, Ленгмюра, а также правило Траубе—Дюкло справедливы для всех случаев адсорбции ПАВ (в том числе и на границе твердого тела с жидкостью). Адсорбцию на порошкообразном адсорбенте можно выразить количественно с учетом концентрации растворенного вещества. Величину избыточной (гиббсовской) адсорбции можно определить по формуле:
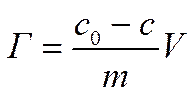
с0 – исходная концентрация ПАВ; m – масса адсорбента; с – конечная концентрация ПАВ; V – объем раствора.
Адсорбция будет выражаться в моль/кг, если с имеет размерность моль/м3, V — м3, а т — кг.
Данное уравнение используют для определения количества ПАВ, адсорбируемого на поверхности твердого тела.
В отличие от адсорбции ПАВ на границе Ж-Г ориентация адсорбционного слоя молекул ПАВ зависит от свойств адсорбата и адсорбента.
а б
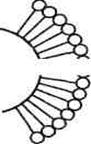 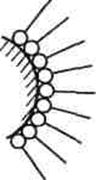
| Строение адсорбционного слоя молекул ПАВ: а - неполярное тело (уголь), полярная жидкость (вода); б - полярное тело (диоксид кремния), неполярная жидкость (бензол) |
На границе вода — воздух (рис. ) молекулы ПАВ ориентированы всегда одинаково: гидрофильной полярной частью к воде, а гидрофобным углеводородным неполярным радикалом - к воздуху
Ориентация молекул ПАВ на границе раздела «твердое тело — жидкость» происходит в соответствии с правилом уравнивания полярности Ребиндера. Граница раздела «неполярное твердое тело — полярная жидкость» в результате адсорбции заменяется на границу раздела «полярная часть адсорбционного слоя на твердой поверхности — полярная жидкость». Происходит уравнивание полярности фаз: из неполярно-полярной граница раздела становится полярно-полярной.
Адсорбция ПАВ на твердой поверхности происходит самопроизвольно, приводит к снижению свободной поверхностной энергии и одновременно вызывает снижение прочности твердого тела - эффект Ребиндера. Этот эффект не связан с коррозией, растворением твердого тела и другими побочными явлениями, а вызван исключительно адсорбцией ПАВ.
Снижение поверхностного натяжения по Ребиндеру можно выразить следующим образом:
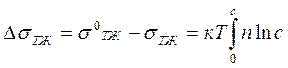
где σ0тж, σтж — межфазовое поверхностное натяжение жидкости и раствора ПАВ; п - число молекул адсорбата, определяемое по уравнению n=Г•NA; с - концентрация адсорбтива ПАВ.
2.3. Адсорбция ионов
Адсорбция ионов на твердой поверхности протекает в том случае, когда эта поверхность соприкасается с растворами электролитов. Ионы одного знака удерживаются на твердой поверхности сильнее, чем ионы другого знака, которые остаются в растворе. Удержание ионов твердым телом определяется электростатическими и химическими силами, которые зависят от свойств твердого тела и самих ионов. Адсорбция ионов происходит в соответствии с некоторыми эмпирическими правилами.
При адсорбции ионов на кристаллических поверхностях прослеживается определенная закономерность: адсорбируются те ионы, которые способны достраивать кристаллическую решетку твердого тела, находятся в избытке и дают труднорастворимые соединения. Эту особенность адсорбции ионов по имени авторов, установивших ее, называют правилом Фаянса — Панета.
На примере кристалла AgI (рис.): ионы Ag+ в кристалле обозначены «+», а ионы I- - «—». Когда твердая кристаллическая поверхность соприкасается с раствором AgN03, то адсорбируются ионы, способные достраивать кристаллическую решетку, т.е. ионы Ag+. Поверхность твердого тела приобретает положительный заряд. В растворе KI адсорбируются анионы I-, и поверхность заряжается отрицательно.
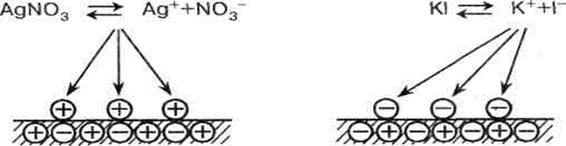
а AgI б
Существуют еще и другие эмпирические правила, характеризующие особенности адсорбции ионов разного размера и заряда. Для ионов одинакового знака чем больше порядковый номер элемента, тем выше его способность к адсорбции. Максимальной адсорбцией обладают ионы наибольшего размера.
Адсорбционная способность ионов находится в прямой зависимости от размеров гидратной оболочки и ее экранирующего действия.
Ряд ионов одинаковой валентности, расположенных в порядке их способности к адсорбции, называют лиотропным рядом.
Li+ < Na+ < K+ < Rb+ < Cs+
Mg2+ < Са2+ < Sr2+ < Ba2+
Существуют лиотропные ряды и для анионов, в частности одновалентных:
С1-< Br-<NO3-< I-< NCS-
В лиотропном ряду крайний левый ион обладает наименьшей адсорбционной способностью, а крайний справа - наибольшей.
Адсорбция ионов зависит и от величины его заряда — чем выше заряд ионов, тем значительнее адсорбционная способность этих ионов.
2.4. Ионообменная адсорбция
Помимо адсорбции ионов возможен обмен между ионами раствора и твердой поверхности. Ионный обмен связан с адсорбцией ионов из раствора электролита и десорбции ионов из твердой поверхности в раствор. Поэтому ионный обмен называют ионообменной адсорбцией.
Ионный обмен — это обратимый процесс эквивалентного (сте-хиометрического) обмена ионами между раствором электролитов и твердым телом (ионитом). Иониты, которые еще называют ионо-обменниками или ионообменными сорбентами, представляют собой вещества, способные к ионному обмену при контакте с растворами электролитов. Ионит имеет две группы ионов (рис.), одна из них содержится в фазе ионита, а другая способна диссоциировать и является электролитом.
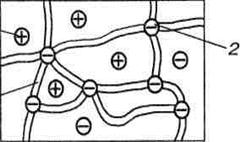
| Рис. Модель матрицы катионита: 1 - каркас; 2 - фиксированный анион; 3 - подвижный катион, способный к ионному обмену |
По знаку обмениваемых ионов различают катиониты и аниониты. Они состоят из каркаса (матрицы), который обладает определенным зарядом, и ионом, способным к обмену. Катионит имеет закрепленные анионогенные группы и катионы, способные к обмену с окружающей средой. Если обозначить каркас катионита через [...], то типичная реакция катионного обмена выглядит следующим образом:
раствор
Кат+1[...]- + Кат+2 → Кат+2 [...]- + Кат+1
Анионы содержат закрепленные катионогенные группы и способные к обмену анионы. Реакция анионного обмена происходит по схеме
раствор
[...]+ Ан-1 + Ан-2 → [...]+Ан-2 + Ан-1
Катиониты содержат катионы Кат+, которые способны обмениваться на такие ионы раствора, как Н+, Na+, K+, Ca2+, Mg2+ и др. У анионов обменными являются анионы Ан-: ОН-, С1-, SО42- и др., а каркас несет положительный заряд. Существуют еще амфолиты, которые в зависимости от условий способны проявлять катионообменные и анионообменные свойства.
Ионный обмен имеет некоторое сходство с адсорбцией — на поверхности твердого тела происходит концентрирование ионов растворенного вещества. В то же время ионный обмен представляет собой стехиометрическое замещение — в обмен на адсорбцию ионит отдает в раствор эквивалентное количество другого иона с зарядом того же знака. Подобный процесс в случае адсорбции отсутствует. На практике трудно провести грань между процессами адсорбции и замещения, особенно учитывая, что адсорбенты могут быть одновременно и ионитами.
 2014-01-31
2014-01-31 1002
1002








