Методы получения коллоидных растворов также можно разделить на две группы: методы конденсации и диспергирования (в отдельную группу выделяется метод пептизации, который будет рассмотрен позднее). Еще одним необходимым для получения золей условием, помимо доведения размеров частиц до коллоидных, является наличие в системе стабилизаторов – веществ, препятствующих процессу самопроизвольного укрупнения коллоидных частиц.
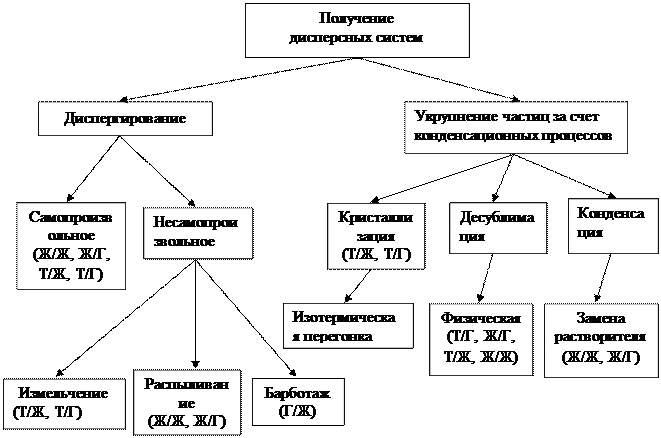
Рис. Классификация способов получения дисперсных систем (в скобках указан вид систем)
Дисперсионные методы
Дисперсионные методы основаны на раздроблении твердых тел до частиц коллоидного размера и образовании таким образом коллоидных растворов. Процесс диспергирования осуществляется различными методами: механическим размалыванием вещества в т.н. коллоидных мельницах, электродуговым распылением металлов, дроблением вещества при помощи ультразвука.
Диспергирование может быть самопроизвольное и несамопроизвольное. Самопроизвольное диспергирование характерно для лиофильных систем и связано с ростом беспорядка системы (когда из одного большого куска образуется много мелких частиц). При диспергировании при постоянной температуре рост энтропии должен превышать изменение энтальпии.
В отношении лиофобных систем самопроизвольное диспергирование исключено, поэтому диспергирование возможно лишь путем затраты определенной работы или эквивалентного количества теплоты, которое измеряется, в частности, энтальпией.
Изменение энтальпии в изобарно-изотермическом процессе определяется соотношением между работой когезии Wки работой адгезии Wа. Энергия (работа) когезии Wкхарактеризует связь внутри тела, а энергия (работа) адгезии Wа — связь его с окружающей средой.
Энергию образования новой поверхности можно выразить через энтальпию, которая имеет вид:
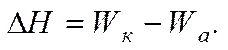
Уравнение показывает изменение энтальпии в результате диспергирования. Для лиофильных систем, способных к самопроизвольному диспергированию, когда ΔS > 0, из условия следует, что ΔH < 0 и:
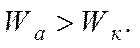
Выполнение данного условия означает самопроизвольный распад большого куска на множество мелких. Подобный процесс наблюдается для таких лиофильных систем, как растворы ВМС, частицы глины и некоторые другие.
В отличие от лиофильных в лиофобных системах когезия Wкбольше энергии межфазового взаимодействия, т.е. адгезии Wа. Рост энтальпии (ΔН > 0) соответствуют увеличению энергии Гиббса:
ΔН > TΔS; ΔG > 0.
Процесс диспергирования в этом случае является типично несамопроизвольным и осуществляется за счет внешней энергии.
Диспергирование характеризуется степенью диспергирования. Она определяется отношением размеров исходного продукта и частиц дисперсной фазы полученной системы. Степень диспергирования можно выразить следующим образом:
α1 = dн/dк; α2 = Bн/Bк; α3 = Vн/Vк,
где dн; dк; Bн; Bк; Vн; Vк — соответственно диаметр, площадь пoвepxнocти, объем частиц до и после диспергирования.
Таким образом, степень диспергирования может быть выражена в единицах размера (α1), площади поверхности (α2) или объема (α3) частиц дисперсной фазы, т.е. может быть линейной, поверхностной или объемной.
Работа W, необходимая для диспергирования твердого тела или жидкости, затрачивается на деформирование тела Wди на образование новой поверхности раздела фаз Wа, которая измеряется работой адгезии. Деформирование является необходимой предпосылкой разрушения тела. Согласно П.А. Ребиндеру работа диспергирования определяется по формуле
W = Wa+ Wд = σ*ΔB + кV,
где σ* — величина, пропорциональная или равная поверхностному натяжению на границе раздела между дисперсной фазой и дисперсионной средой; ΔB — увеличение поверхности раздела фаз в результате диспергирования; V — объем исходного тела до диспергирования; к — коэффициент, эквивалентный работе деформирования единицы объема тела.
Методы конденсации
К конденсационным методам получения дисперсных систем относятся конденсация, десублимация и кристаллизация. Они основаны на образовании новой фазы в условиях пересыщенного состояния вещества в газовой или жидкой среде. При этом система из гомогенной переходит в гетерогенную. Конденсация и десублимация характерны для газовой, а кристаллизация — для жидкой среды.
Необходимым условием конденсации и кристаллизации является пересыщение и неравномерное распределение вещества в дисперсионной среде (флуктуация концентрации), а также образование центров конденсации или зародышей.
Степень пересыщения β для раствора и пара можно выразить следующим образом:
βж= с/сs, βП= р/рs,
где р, с — давление пересыщенного пара и концентрация вещества в пересыщенном растворе; рs— равновесное давление насыщенного пара над плоской поверхностью; сs— равновесная концентрация, соответствующая образованию новой фазы.
Для осуществления кристаллизации охлаждают раствор или газовую смесь.
В основе конденсационных методов получение дисперсных систем лежат процессы кристаллизации, десублимации и конденсации, которые вызваны уменьшением энергии Гиббса (ΔG < 0) и протекают самопроизвольно.
При зарождении и образовании частиц из пересыщенного раствора или газовой среды изменяется химический потенциал µ, возникает поверхность раздела фаз, которая становится носителем избыточной свободной поверхностной энергии.
Работа, затрачиваемая на образование частиц, определяется поверхностным натяжением σ и равна:
W1 = 4πr2σ,
где 4πr2 — поверхность сферических частиц радиусом r.
Химический потенциал изменяется следующим образом:
Δμ = μi// – μi/ < 0; μi// > μi/,
где μi/ и μi// — химические потенциалы гомо и гетерогенных систем (при переходе от мелких капель к крупным).
Изменение химического потенциала характеризует перенос определенного числа молей вещества из одной фазы в другую; это число n молей равно объему частицы 4πr3/3, деленному на мольный объем Vм:
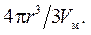
Работа образования новой поверхности в процессе конденсации Wк равна:
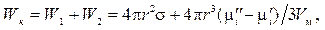
где W1и W2 — соответственно работа, затрачиваемая на образование поверхности частиц, и работа на перенос вещества из гомогенной среды в гетерогенную.
Образование дисперсных систем может происходить в результате физической и химической конденсации, а также при замене растворителя.
Физическая конденсация осуществляется при понижении температуры газовой среды, содержащей пары различных веществ. При выполнении необходимых условий образуются частицы или капли дисперсной фазы. Подобный процесс имеет место не только в объеме газа, но и на охлажденной твердой поверхности, которую помещают в более теплую газовую среду.
Конденсация определяется разностью химических потенциалов (μi// – μi/) < 0, которая изменяется в результате замены растворителя. В отличие от обычной физической конденсации при замене растворителя состав и свойства дисперсионной среды не остаются постоянными. Если спиртовые или ацетоновые растворы серы, фосфора, канифоли и некоторых других органических веществ влить в воду, то раствор становится пересыщенным, происходит конденсация и образуются частицы дисперсной фазы. Метод замены растворителя является одним из немногих, при помощи которых можно получить золи.
При химической конденсации происходит образование вещества с одновременным его пересыщением и конденсацией.
 2014-01-31
2014-01-31 2204
2204
