Распад фосфолипидов. В клетках листьев большая часть фосфолипидов находится в связанном состоянии, так как они участвуют в построении клеточных мембран. Переход их в свободное состояние может происходить при перестройке и обновлении структур клеточных мембран. В несвязанном (свободном) состоянии много фосфолипидов откладывается в семенах, где они используются в качестве запасных веществ. При прорастании семян наблюдается высокая активность гидролитических ферментов, катализирующих распад запасных веществ, в том числе и запасных фосфолипидов, главным образом фосфатидилэтаноламинов и фосфатидилхолинов.
О
Следует отметить, что в процессе синтеза фосфолипидов реализуется такой механизм присоединения ацильных радикалов к глицерол-3-фосфату, при котором радикал R1 обычно представлен остатком насыщенной жирной кислоты, а радикал R2 – остатком ненасыщенной кислоты.
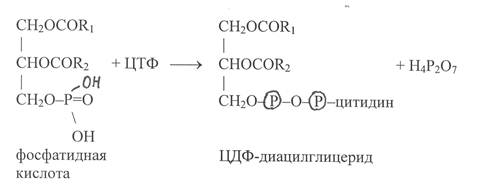
При синтезе фосфолипидов в хлоропластах и митохондриях активированию подвергается фосфатидная кислота в результате взаимодействия с ЦТФ:
В последующих реакциях остаток цитидиловой кислоты в молекуле ЦДФ-диацилглицерида может замещаться на серин или миоинозит, в результате осуществляется синтез фосфатидилсерина и фосфатидил-инозита:
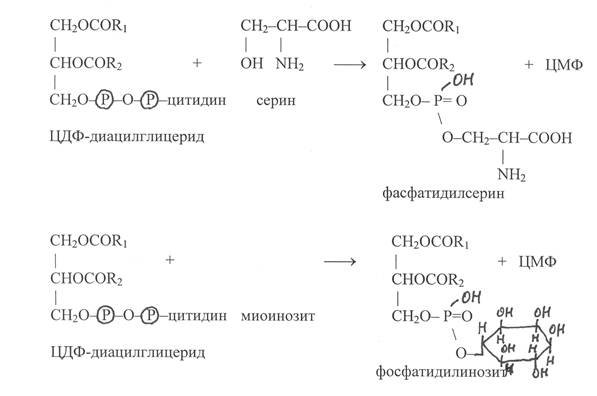
Фосфатидилсерины могут также синтезироваться при замещении остатков холина или этаноламина в молекулах фосфатидилхолинов или фосфати-дилэтаноламинов на серин:
фосфатидилэтаноламин + серин ¾® фосфатидилсерин + этаноламин
фосфатидилхолин + серин ¾® фосфатидилсерин + холин
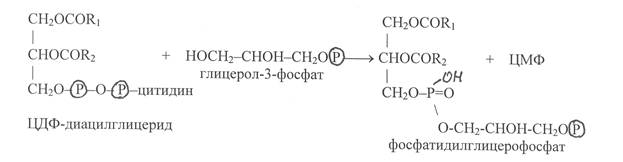
В реакцию с ЦДФ-диглицеридом может вступать глицерол-3-фосфат с образованием фосфатидилглицерофосфата:
Далее в результате гидролиза фосфоэфирной связи от молекулы фосфатилглицерофосфата отщепляется остаток фосфорной кислоты и происходит образование фосфатидилглицерина:
фосфатидилглицерофосфат + Н2О ¾® фосфатидилглицерин + Н3РО4
9.3. Распад жиров и фосфолипидов.
В процессе синтеза ацилглицеринов жира происходит образование сложноэфирных связей между остатками глицерина и жирных кислот. В ходе распада ацилглицеринов происходит обратный процесс – расщепление сложноэфирных связей гидролитическими ферментами липазами (3.1.1.3). Особенно высока активность липаз в прорастающих семенах масличных растений, у которых главными запасными веществами являются жиры. Под действием липаз жиры с участием воды расщепляются до глицерина и свободных жирных кислот:
|
В ходе реакции гидролиза фермент последовательно катализирует расщеп-ление первой сложноэфирной связи триацилглицерина, затем второй и далее третьей.
Большинство липаз находится в клетках растений или микроорганизмов в растворимом состоянии и имеют оптимум каталитического действия при рН 8. Для проявления каталитической активности липаз необходимо присутствие в физиологической среде катионов Са2+.
Образовавшиеся при гидролизе жира глицерин и жирные кислоты подвергаются дальнейшим превращениям. Глицерин вначале фосфорилируется от АТФ под действием фермента глицеролкиназы (2.7.1.30) и превращается в глицерол-3-фосфат:
|
|
|
Дальнейшие превращения фосфодиоксиацетона и 3-фосфоглицери-нового альдегида могут происходить в двух направлениях: они могут участвовать в синтезе углеводов или включаться в дыхательные реакции.
Если в клетках организма осуществляется превращение запасных жиров в углеводы, например, при прорастании семян масличных растений, под действием фермента альдолазы фосфодиоксиацетон и 3-фосфогли-цериновый альдегид конденсируются с образованием фруктозо-1,6-дифосфата, который превращается во фруктозо-6-фосфат, способный далее включаться в синтез различных углеводов по уже известным нам механизмам.
С другой стороны, 3-фосфоглицериновый альдегид может включаться в реакции дыхания и использоваться как энергетический материал. В этом случае он окисляется в анаэробной стадии дыхания до пировиноградной кислоты, которая в результате окислительного декарбоксилирования образует ацетил-КоА, включающийся далее в реакции цикла Кребса.
Другие продукты гидролиза жиров – жирные кислоты – подвергаются окислению у человека и животных преимущественно под действием ферментов, локализованных во внутреннем матриксе митохондрий, а у растений в значительном количестве ещё и в цитоплазме клеток. В соответствии с этим у растений различают два механизма окисления жирных кислот: a-окисление и b-окисление.
Распад жирных кислот по механизму a-окисления осуществляется в цитоплазме растительных клеток и происходит в две стадии. На первой стадии жирная кислота подвергается действию фермента пероксидазы жирных кислот (1.11.1.3), который с участием пероксида водорода катализирует окислительное декарбоксилирование жирной кислоты с образованием альдегида:
O
//
жирная кислота альдегид
жирной кислоты
На второй стадии a-окисления альдегид жирной кислоты окисляется до кислоты под действием фермента дегидрогеназы альдегидов жирных кислот (1.2.1.3), имеющего в качестве кофермента нуклеотидную группировку НАД:
О О
// //
R2–CH2–C–Н + Н2О + НАД+ ¾® R2–CH2–C–ОН + НАД×Н + Н+
В результате a-окисления кислород присоединяется к a-углеродному атому жирной кислоты, а от карбоксильной группы отщепляется СО2 и углеродная цепь жирной кислоты становится короче на один углеродный атом. При многократном повторении a-окисления происходит деградация жирной кислоты на СО2 и воду. Но в ходе окисления альдегидов жирных кислот на каждую молекулу выделившегося в предшествующей реакции СО2 синтезируется 1 молекула восстановленного динуклеотида НАД×Н. Таким образом, при a-окислении жирных кислот часть их свободной энергии используется для синтеза динуклеотидов НАД×Н, которые могут далее участвовать в восстановительных реакциях, лежащих в основе синтеза различных биохимических продуктов растительной клетки. Наиболее активно a-окисление жирных кислот происходит в прорастающих семенах масличных культур.
Распад жирных кислот по механизму b-окисления проходит во внутреннем матриксе митохондрий. Большая часть жирных кислот находится не в свободном виде, а превращается в КоА-производные под действием ацил-КоА-синтетазы (6.2.1.3). В ходе такого превращения осуществляется сопряжённый синтез ацил-КоА за счёт гидролиза АТФ:
О
//
R–CH2–CH2–C–OH + HS–КоА + АТФ ¾® R–CH2–CH2–C~S–КоА + АМФ + Н4Р2О7
||
жирная кислота ацил-КоА
Известны ацил-КоА-синтетазы, которые катализируют активирование жирных кислот с длиной цепью, а другие – с более короткой цепью (4-12 углеродных атомов).
В переносе КоА-производных жирных кислот через мембраны митохондрий участвуют молекулы карнитина, имеющего биполярную группирову. Во внутренней мембране митохондрий имеется ацилтрансфераза, катализирующая перенос ацильных остатков с КоА на карнитин по следующей схеме:
СН2–N+(СН3)3 СН2–N+(СН3)3
| /
R–C~S–КоА + НО-С-Н ¾® R–С–О–СН + НS–КоА
|| | || \
O СН2–СОО- O СН2–СОО‾
ацил-КоА карнитин сложный эфир карнитина
и жирной кислоты
В соединении с карнитином жирная кислота проникает через мембраны митохондрий во внутренний митохондриальный матрикс, где осуществляется замещение остатка карнитина снова на кофермент А. Определённая часть жирных кислот (до 30%) могут проходить через мембраны митохондрий в свободном виде и их соединение с коферментом А уже происходит в митохондриальном матриксе.
Активированные жирные кислоты, соединённые с коферментом А, в митохондриальном матриксе подвергаются действию фермента ацил-КоА-дегидрогеназы (1.3.99.3), имеющего в качестве простетической группы ФАД. В ходе реакции окисления от остатка жирной кислоты отщепляются электроны и протоны с образованием a,b-ненасыщенного производного жирной кислоты, присоединённой к коферменту А:
R–СН2–СН2–С~S–КоА + ФАД ¾® R–СН=СН–С~S–КоА + ФАД×Н2
|| ||
О О
ацил-КоА ненасыщенное ацил-
КоА-производное
От образовавшегося b-оксиацил-КоА-производного жирной кислоты отщепляется водород. Эту реакцию катализирует фермент 3-оксоацил-КоА-дегидрогеназа (1.1.1.35), имеющий в активном центре кофермент НАД:
R–CН–CН2–С~S–КоА + НАД+ ¾® R–С–СН2–С~S–КоА + НАД×Н + Н+
│ ║ ║ ║
ОН О О О
b-оксиацил-КоА β-оксоацил-КоА
Под действием 3-оксоацил-КоА-дегидрогеназы атомы водорода отщепляются от b-углеродного атома, в результате чего оксипроизводное жирной кислоты превращается в кетопроизводное – b-оксоацилкофермент А. На последнем этапе b-окисления b-оксоацил-КоА-поизводное жирной кислоты взаимодействует со свободной молекулой кофермента А, образуя два продукта – ацетил-КоА и ацил-КоА, который имеет углеродную цепь на два углеродных атома короче исходной жирной кислоты. Синтез этих продуктов катализирует фермент ацил-КоА-тиолаза (2.3.1.9):
R–C–CН2–С~S–КоА + НS–КоА ¾® R–С~S–КоА + CН3–С~S–КоА
║ ║ ║ ║
О О О О
β-оксоацил-КоА ацил-КоА ацетил-КоА
В связи с тем, что конечный этап окисления КоА-производного жирной кислоты с образованием b-оксоацил-КоА происходит у b-углеродного атома, весь цикл представленных здесь реакций получил название b-окисления жирных кислот. Остаток жирной кислоты, укороченный на два углеродных атома, вновь вступает в реакции b-окисления и от него отщепляется молекула ацетил-КоА. Затем цикл реакций b-окисления повторяется снова и снова до тех пор, пока вся цепочка жирной кислоты, имеющая чётное число углеродных атомов, не будет расщеплена полностью на молекулы ацетил-КоА.
Если же b-окислению подвергается жирная кислота с нечётным числом углеродных атомов, то в результате каждого цикла реакций b-окисления будут отщепляться двууглеродные фрагменты ацетил-КоА, однако на последнем этапе b-окисления в результате отщепления ацетил-КоА остаётся конечный фрагмент молекулы жирной кислоты в виде пропионил-КоА. В матриксе митохондрий имеется набор ацил-КоА-тиолаз, специфичных к цепям жирных кислот разной длины.
Как указывалось ранее, в организмах встречаются жирные кислоты, имеющие боковые радикалы, как правило, в виде метильной группы. При этом такие ответвления обычно находятся у чётных углеродных атомов жирной кислоты. В опытах выяснено, что жирные кислоты с боковыми метильными радикалами у чётных углеродных атомов подвергаются b-окислению, но в результате тиолазной реакции от остатка жирной кислоты отщепляется не ацетил-КоА, а молекула пропионил-КоА:
СН3
|
R–С–СН–С~S–КоА + НS–КоА ¾® R–С~S–КоА + СН3–СН2–С~S–КоА
|| || || ||
О О О О
b-оксоацил-КоА ацил-КоА пропионил-КоА
Если же боковые радикалы присоединены к нечётным углеродным атомам, то b-окисление жирной кислоты блокируется на стадии образования b-оксиацил-КоА-производного, так как возникающий на этой стадии b-окисления продукт не может окисляться ферментом b-оксоацил-КоА-дегидрогеназой:
СН3
|
R–С–СН2–С~S–КоА + НАД+ ¾® реакция не идёт
| ||
ОН О
Впервые отрицательные последствия блокирования b-окисления жирных кислот наблюдали в сельскохозяйственной отрасли. В ряде развитых стран до 1966 г. в больших количествах применяли синтетические ферменты с беспорядочно расположенными метильными радикалами в их жирнокислотных цепях. В результате процесс их b-окисления при биодеградации почвенными микроорганизмами блокировался в точках, где метильные радикалы были присоединены к нечётным углеродным атомам. Последнее приводило к накоплению пенистых образований в почве, наносивших значительный ущерб урожайности сельскохозяйственных культур. После этого было принято решение производить детергенты только на основе жирных кислот с неразветвленными углеродными цепями.
У некоторых микроорганизмов при блокировании процесса b-окисления жирных кислот в качестве обходного пути используется механизм a-окисления, или процесс окисления начинается с противоположного по отношению к карбоксильной группе конца. В этом случае вначале гидроксилированию подвергается первичный углеродный атом с образованием оксипроизводного жирной кислоты, которое затем окисляется в альдегид, а последний – в карбоновую кислоту, способную далее вступать в реакции a-окисления. Окисление жирной кислоты с противоположного от карбоксильной группы конца получил название w- окисления.
У растений и микроорганизмов большая часть жирных кислот в составе липидов являются представителями ненасыщенного ряда. Но они так же, как и насыщенные кислоты, подвергаются b-окислению, образуя в качестве конечного продукта ацетил-КоА. Если в процессе окисления после очередного отщепления ацетил-КоА двойная связь ненасыщенной кислоты оказывается в a,b-положении, то в этом случае нормально происходят последующие реакции b-окисления. Однако, если двойная связь оказывается смещённой в b, g-положение, то для нормального осуществления реакций b-окисления требуется перемещение двойной связи в a,b-положение. Такую реакцию осуществляют специфические изомеразы ненасыщенных жирных кислот.
Основной продукт b-окисления жирных кислот ацетил-КоА может далее участвовать в двух видах превращений – окисляться в дыхательных реакциях до СО2 и Н2О или использоваться на синтез углеводов.
Значительная часть молекул ацетил-КоА, образующихся в ходе b-окисления жирных кислот, вступает в реакции цикла Кребса, которые локализованы во внутреннем матриксе митохондрий. Окисление одной молекулы ацетил-КоА в реакциях цикла Кребса даёт три молекулы восстановленных динуклеотидов НАД×Н, одну молекулу ФАД×Н2 и одну молекулу АТФ за счёт субстратного фосфорилирования при фосфоролизе сукцинил-КоА. Как мы уже знаем, восстановленные динуклеотиды НАД×Н и ФАД×Н2 внутри митохондрий окисляются в системе окислительного фосфорилирования, обеспечивая синтеез АТФ. При окислении одной молекулы НАД×Н возможно образование 3 молекул АТФ, а при окислении одной молекулы ФАД×Н2 – двух молекул АТФ. Всего за счёт окисления одной молекулы ацетил-КоА возможен синтез (3АТФ х 3НАД×Н) + (2АТФ х ФАД×Н2) + АТФ = 12 молекул АТФ.
В ходе реакций b-окисления жирных кислот также синтезируются восстановленные динуклеотиды ФАД×Н2 и НАД×Н, которые, поступая в систему окислительного фосфорилирования, используются для синтеза АТФ. В каждом цикле β-окисления насыщенной жирной кислоты образуется по одной молекуле НАД·Н и ФАД·Н2, что может обеспечить синтез 5 молекул АТФ. Однако при оценке общего выхода АТФ при β-окислении каждой молекулы жирной кислоты следует учитывать, что одна молекула АТФ затрачивается на активирование жирной кислоты путём её перевода в ацил-КоА-производное.
Попытаемся сравнить энергетический эффект окисления жирных кислот и углеводов. В качестве примера для расчёта энергетического эффекта окисления жирных кислот возьмём стеариновую кислоту, а углеводов – глюкозу. Стеариновая кислота имеет углеродную цепь, включающую 18 атомов углерода. В ходе её распада 8 раз повторяется цикл реакций b-окисления и образуется 9 молекул ацетил-КоА. Как было показано ранее, в каждом цикле b-окисления накапливаются восстановленные динуклеотиды, при окислении которых в системе окислительного фосфорилированя могут синтезироваться 5 молекул АТФ, а за 8 циклов реакций b-окисления – могут синтезироваться соответственно 40 молекул АТФ.
При окислении в дыхательных реакциях 1 молекулы ацетил-КоА возможно образование 12 молекул АТФ, а в результате окисления 9 молекул ацетил-КоА могут синтезироваться 108 молекул АТФ. Таким образом, в результате окисления одной молекулы стеариновой кислоты через механизм b-окисления и дыхательных реакций возможно образование в системе окислительного фосфорилирования 40 + 108 = 148 молекул АТФ. Однако, если учесть, что одна молекула АТФ затрачивается на активирование жирной кислоты, то окончательный выход АТФ при окислении одной молекулы стеариновой кислоты составляет 147 молекул АТФ (или 147 молей АТФ в расчёте на 1 моль стеариновой кислоты).
Если произвести расчёт выхода АТФ при окислении 1 г стеариновой кислоты (284 г/моль), то получим следующий результат: 147: 284 = 0,52 моля АТФ в расчёте на 1 г стеариновой кислоты. В главе «Обмен углеводов» (стр. 400) было показано, что при окислении 1 моля глюкозы (180 г/моль) синтезируется 38 молей АТФ (или 38: 180 = 0,21 моль АТФ в расчёте на 1 г глюкозы). Из этих показателей видно, что энергетический эффект окисления одной единицы массы стеариновой кислоты более чем в 2 раза превышает эффективность окисления глюкозы.
В качестве примера нами определён энергетический эффект окисления насыщенной жирной кислоты – стеариновой. Однако ненасыщенные жирные кислоты также дают высокий выход АТФ при их окислении в митохондриях. У них только на одном из этапов окисления, когда в реакцию вступает ненасыщенное производное, не происходит образования ФАД×Н2, которое в системе окислительного фосфорилирования обеспе-чивает синтез двух молекул АТФ. Поэтому в ходе окисления каждого моля ненасыщенной жирной кислоты с одной двойной связью выход АТФ уменьшается на 2 моля, с двумя двойными связями – на 4 моля, с тремя двойными связями – на 6 молей. Следовательно, в процессе окисления в митохондриях 1 моля линоленовой кислоты, имеющей 3 двойные связи, выход АТФ по сравнению со стеариновой кислотой будет составлять не 147 молей, а 141. 147 молей, а 141. И в расчёте на 1 г окисляемой линоленовой кислоты выход АТФ составит 0,51 моля, то есть значительно больше, чем для глюкозы и других углеводов.
Как было показано ранее, определённая часть жирных кислот, образующихся при распаде жиров, у растений подвергается a-окислению в цитоплазме и при каждом обороте a-окисления происходит отщепление от жирной кислоты одной молекулы СО2 и синтез одной молекулы восстановленного динуклеотида НАД×Н. Следовательно, если даже предположить, что происходит полное окисление жирной кислоты, то может осуществиться синтез такого числа молекул НАД×Н, которое на один меньше числа углеродных атомов в молекуле жирной кислоты.
Например, для молекулы стеариновой кислоты оно будет равно 17. Если сделать пересчёт синтезированных молекул НАД×Н в эквиваленты АТФ, принятые для системы окислительного фосфорилирования, то мы получим выход АТФ значительно меньший, чем при окислении жирных кислот по механизму b-окисления и последующего окисления ацетилкофермента А в цикле Кребса. Однако, надо иметь в виду, что большая часть восстановленных динуклеотидов НАД×Н, образуемых в цитоплазме по механизму a-окисления, не окисляется в системе окислительного фосфорилирования митохондрий, а используется в восстановительных реакциях, происходящих в цитоплазме.
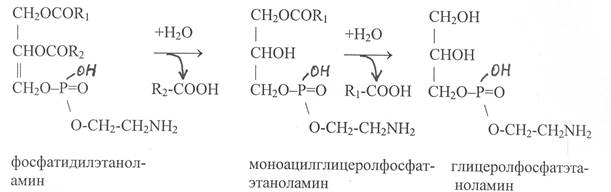 |
Распад фосфолипидов начинается с действия фосфолипаз, катализирующих гидролиз сложноэфирных связей глицерина и жирных кислот. Вначале происходит отщепление остатка жирной кислоты, связанного со вторым углеродным атомом, а затем связанного с первым углеродным атомом. В результате действия этих ферментов образуются свободные жирные кислоты и соединения азотистого основания с глицеролфосфатом:
На следующем этапе под действием специфической фосфатазы гидролизу подвергается сложноэфирная связь между остатком глицерина и фосфатом азотистого основания:
|
Гидролиз образовавшегося этаноламинфосфата также катализирует специфическая фосфатаза:
фосфатаза
(Р)–О–СН2–СН2NH2 + Н2О ¾¾® НО–СН2–СН2NH2 + Н3РО4
этаноламинфосфат этаноламин
Под действием указанных ферментов осуществляется превращение фосфолипидов в свободный глицерин, жирные кислоты, азотистые основания и неорганический фосфат, которые далее могут включаться в различные биохимические реакции или окисляться в процессе дыхания.
У растений процесс распада жиров интенсивно происходит при прорастании семян, в которых они служат основным запасным веществом. При этом часть запасного жира в прорастающих семенах расходуется как энергетический материал для инициации сопряжённого синтеза органических веществ, необходимых для жизнедеятельности развивающихся проростков, а другая часть является источником органических метаболитов для построения молекул структурных и функционально активных компонентов их клеток. Важнейший путь использования жиров в качестве биохимических метаболитов – это превращение их в углеводы, которое осуществляется через реакции глиоксилатного цикла, называемого также циклом глиоксиловой кислоты.
Ферменты, катализирующие реакции глиоксилатного цикла, лакализованы в специализированных внутриклеточных структурах – глиоксисомах, которые функционально связаны с митохондриями. Участие глиоксисом в превращении жирных кислот в углеводы наиболее хорошо изучено при прорастании семян масличных растений. Глиоксисомы формируются в начале прорастания этих семян и деградируют после полного расщепления жира. Кроме ферментов глиоксилатного цикла в глиоксисомах также содержатся ферменты, катализирующие b-окисление жирных кислот. Продукт b-окисления жирных кислот – ацетил-КоА – далее включается в реакции глиоксилатного цикла.
Первые три реакции этого цикла такие же как и в цикле Кребса. Вначале ацетил-КоА реагирует с енольной формой щевелевоуксусной кислоты, образуя лимонную кислоту. Затем последовательно происходит превращение лимонной кислоты в цис -аконитовую и изолимонную кислоты:
(1-3)
| СН-СООН СН2-СООН СН2-СООН СН2-СООН || + СН3-С~S-КоА+Н2О ® | ® | Н₂О | С(ОН)-СООН || ↓ С(ОН)-СООН ↓ C-CООН ® СН-СООН O –НS-КоА | –Н₂О || | СН2-СООН CН-СООН СН(ОН)-СООН Щавелево- ацетил-КоА лимонная цис-акони- изолимонная уксусная кислота товая кислота кислота кислота |
На следующем этапе превращений изолимонная кислота расщепляется ферментом изоцитратлиазой (4.1.3.1) на два продукта – янтарную и глиоксиловую кислоты:
|
Изоцитратлиаза - аллостерический фермент, активность которого подавляется избыточной концентрацией фосфоенолпировиногадной кис-лоты, образующейся в цитоплазме из продуктов превращения янтарной кислоты. Последняя для дальнейших реакций поступает в митохондрию. А глиоксиловая кислота в глиоксисоме вступает во взаимодействие с новой молекулой ацетил-КоА, образуя яблочную кислоту. Эту реакцию катализирует фермент малатсинтаза (4.1.3.2):
|
В последней реакции глиоксилатного цикла яблочная кислота окисляется ферментом малатдегидрогеназой в щавелевоуксусную кислоту:
|
После этого щавелевоуксусная кислота изомеризуется в свою енольную форму и может снова вступать в первую реакцию цикла. Как видно из представленных выше реакций, в глиоксилатный цикл, кроме регенерирующегося субстрата – енольной формы щавелевоуксусной кислоты, включаются две молекулы ацетил-КоА, а продуктами цикла являются янтарная кислота и НАД×Н. Поэтому суммарное уравнение глиоксилатного цикла можно записать в следующем виде:
|
Янтарная кислота, поступающая из глиоксисомы в митохондрию, включается там в реакции цикла Кребса и превращается в щавелевоуксусную кислоту, которая далее из митохондрии транспортируется в цитоплазму, где c участием соответствующих ферментов используется для синтеза углеводов.
|
Образовавшаяся здесь фосфоенолпировиноградная кислота далее включается в уже известный нам цикл реакций обращения гликолиза (стр 375-377), конечным продуктом которого является фруктозо-6-фосфат. А из фруктозо-6-фосфата могут синтезироваться различные углеводы. Но если фруктозо-6-фосфат вступает в дыхательные реакции, дающие кетокислоты, то возможно его использование и на синтез аминокислот. Общая схема превращения жиров в углеводы показана на рисунке 39.
У бактерий реакции глиоксилатного цикла пространственно не отделены от цикла Кребса, поэтому глиоксилатный путь превращений ацетил-КоА можно рассматривать как видоизменённый цикл трикар-боновых кислот. У человека и животных глиоксилатный цикл отсутствует, в связи с чем у данных организмов отложенный в жировых тканях жир не может так легко использоваться для превращения в углеводы, как у бактерий или растений.
Весь процесс биосинтеза углеводов из продуктов распада жира получил название глюконеогенеза. Такое название он имеет вследствие того, что в ходе обращения реакций гликолиза из продукта распада ных кислот фосфоенолпировиноградной кислоты осуществляется синтез важнейшего представителя сахаров–глюкозы, из которой уже довольно легко могут синтезироваться другие углеводы.
 2014-01-31
2014-01-31 1358
1358
