Межгалогенные соединения
Положительные степени окисления галогены проявляют не только в кислородных, но и в так называемых межгалогенных соединениях XYn, где X - более тяжелый, Y - более легкий и более электроотрицательный атомы, а n = 1, 3, 5, 7. Известны также гомоядерные поликатионы 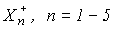 , и полианионы
, и полианионы 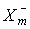 , m = 3,5,7,...21 галогенов.
, m = 3,5,7,...21 галогенов.
Данные соединения образуются при непосредственном взаимодействии простых веществ, например,
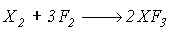 (X =Cl: t=200-3000C; X = Br: t=200C; X = I: t = -450C в растворителе CFCl3).
(X =Cl: t=200-3000C; X = Br: t=200C; X = I: t = -450C в растворителе CFCl3). 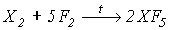 (X =Cl: t=3500 (250 атм),
(X =Cl: t=3500 (250 атм),
X = Br: t >1500C,
X = I: t = 200C)
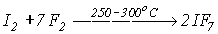 .
.
Условия синтеза МГС, например, ICl и ICl3, удобно рассмотреть с помощью фазовой диаграммы I2-Cl2 (рис.10).
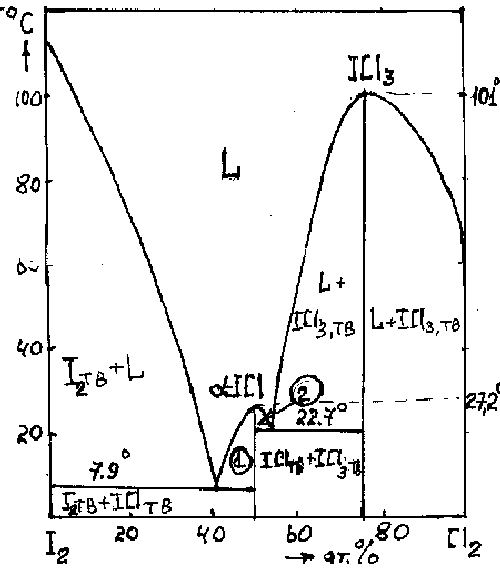
Рис.10. Т-х фазовая диаграмма системы I2-Cl2, L -расплав, (1) - область L+IСlтв; (2) - область L+IСlтв.
В этой системе образуются два конгруэнтно плавящихся соединения:  -ICl (т.пл.27.20С) и ICl3 (т.пл.1010С), образующих между собой эвтектику, имеющую состав 50.5 ат.% хлора и плавящуюся при 22.70С. Монохлорид (известна и метастабильная низкотемпературная форма
-ICl (т.пл.27.20С) и ICl3 (т.пл.1010С), образующих между собой эвтектику, имеющую состав 50.5 ат.% хлора и плавящуюся при 22.70С. Монохлорид (известна и метастабильная низкотемпературная форма  - ICl.) иода ICl кристаллизуется в виде рубиново-красных игольчатых кристаллов, растворимых в CCl4. Их получают пропусканием Cl2 над сухим иодом. Кристаллы ICl с иодом образуют эвтектику, плавящуюся при 7.90С. После того как иод расплавился, образовавшийся ICl отгоняют из эвтектического расплава.
- ICl.) иода ICl кристаллизуется в виде рубиново-красных игольчатых кристаллов, растворимых в CCl4. Их получают пропусканием Cl2 над сухим иодом. Кристаллы ICl с иодом образуют эвтектику, плавящуюся при 7.90С. После того как иод расплавился, образовавшийся ICl отгоняют из эвтектического расплава.
Рыхлый оранжевый порошок ICl3 образуется при обработке ICl или I2 избытком хлора (кристаллы, полученные из пара, имеют лимонно-желтую окраску). Он может быть получен также действием на иод жидкого хлора, так как нерастворим в нем. Полученное вещество летуче уже при комнатной температуре, поэтому его хранят в плотно закрытых сосудах. Во влажном воздухе ICl3 легко разлагается (см.ниже).
Твердый трихлорид иода построен из плоских молекул димеров I2Cl6:
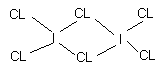
Отметим особенности строения и свойств МГС.
1.Эти полярные молекулярные вещества 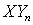 построены таким образом, что более тяжелый атом Х координирует вокруг себя нечетное число (n = 1,3,5,7) более легких и более электроотрицательных атомов
построены таким образом, что более тяжелый атом Х координирует вокруг себя нечетное число (n = 1,3,5,7) более легких и более электроотрицательных атомов 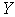 . Величина n увеличивается с ростом отношения радиусов rX /rY
. Величина n увеличивается с ростом отношения радиусов rX /rY
2.Они представляют собой в обычных условиях газы, жидкости или легкоплавкие твердые вещества молекулярного строения. Форму молекулы можно определить по методу Гиллеспи (рис.11).
Рис.11. Строение молекул BrF3, BrF5, BrF7 3.Прочность связи EX-Y (табл.11) зависит от разности электроотрицательности атомов X и Y: чем больше эта разность, тем прочнее связь.
Таблица 11.Разность электроотрицательностей (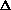 ) и энергии связи (в кДж/моль) Х-Y в молекулах простых веществ и МГС [D8, P.837].
) и энергии связи (в кДж/моль) Х-Y в молекулах простых веществ и МГС [D8, P.837].
 c c
| Увеличение степени окисления | |||
| XY | XY3 | XY5 | XY7 | |
| 1.38 | IF (277.8) | IF3 (272) | IF5 (207.8) | IF7 (231) |
| 1.28 | BrF (249.4) | BrF3 (201.1) | BrF5 (187) | - |
| 0.95 | ClF (248.9) | ClF3 (172.4) | ClF5 (142) | - |
| 0.43 | ICl (207.9) | I2Cl6 | - | - |
| 0.33 | BrCl (215.9) | - | - | - |
| 0.10 | IBr (175.3) | - | - | - |
| F2 (159.0) | - | - | - | |
| Cl2 (243.0) | - | - | - | |
| Br2 (193.0) | - | - | - | |
| I2 (151.0) | - | - | - |
4. В ряду соединений ХYn с одинаковым атомом Y их устойчивость увеличивается с ростом степени окисления атома Х. С этим связана, например, легкость диспропорционирования низших фторидов иода: 5IF = 2I2 + IF5.
5.Физические свойства бинарных МГС занимают промежуточное положение между свойствами образующих их галогенов X2 и Y2. Однако из-за неодинаковой электроотрицательности атомов Х и Y соединения ХY в отличие от X2 и Y2 более полярны.
 2014-01-31
2014-01-31 885
885








