Состояние химического равновесия обратимых процессов количественно характеризуется константой равновесия.
Так для обратимой химической реакции: a А + b В 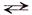 c С + d D, зависимость скоростей прямой (v →) и обратной (v ←) реакций от концентраций реагирующих веществ выражается соотношениями:
c С + d D, зависимость скоростей прямой (v →) и обратной (v ←) реакций от концентраций реагирующих веществ выражается соотношениями:
v → = k 1[A] a ·[B] b v ← = k 2[C] c ·[D] d
В состоянии химического равновесия v → = v ← т.е. k 1[A] a ·[B] b = k 2[C] c ·[D] d, отсюда:
К = k → / k ← = [C] c ·[D] d / [A] a ·[B] b
Состояние химического равновесия при неизменных внешних условиях теоретически может сохраняться бесконечно долго. В реальной действительности, при изменении температуры, давления или концентрации реагентов, равновесие может «сместиться» в ту или иную сторону протекания процесса.
Изменения, происходящие в системе в результате внешних воздействий, определяются принципом подвижного равновесия – принципом Ле Шателье: внешнее воздействие на систему, находящуюся в состоянии равновесия, приводит к смещению этого равновесия в направлении, при котором эффект произведенного воздействия ослабляется.
Принцип Ле Шателье универсален, так как применим не только к химическим процессам, но и к физическим, таким, как плавление, кипение и т.д.
Применительно к трем основным типам внешнего воздействия – изменению концентрации, давления и температуры – принцип Ле Шателье трактуется следующим образом.
При увеличении концентрации одного из реагирующих веществ равновесие смещается в сторону расхода этого вещества, при уменьшении концентрации равновесие смещается в сторону образования этого вещества.
Влияние давления очень напоминает эффект изменения концентраций реагирующих веществ, но сказывается оно только на газовых системах. Сформулируем общее положение о влиянии давления на химическое равновесие.
При увеличении давления равновесие смещается в сторону уменьшения количеств газообразных веществ, т.е. в сторону понижения давления; при уменьшении давления равновесие смещается в сторону возрастания количеств газообразных веществ, т.е. в сторону увеличения давления. Если реакция протекает без изменения числа молекул газообразных веществ, то давление не влияет на положение равновесия в этой системе.
При изменении температуры изменяются как прямая, так и обратная реакции, но в разной степени. Следовательно, для выяснения влияния температуры на химическое равновесие необходимо знать знак теплового эффекта реакции.
При повышении температуры равновесие смещается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Необратимые реакции – реакции, продукты которых не взаимодействуют друг с другом с образованием исходных веществ.
KClO3 → 2KCl + 3O2↑
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
Необратимые реакции, как правило, «доходят до конца», т.е. до полного израсходования хотя бы одного из исходных веществ. Обратимые реакции не протекают до конца, но если один из продуктов обратимой реакции покидает сферу реакции, то по существу обратимый процесс протекает практически до конца.
 2014-01-31
2014-01-31 756
756








