Подготовительные стадии
Трансляция
Трансляция – процесс перевода генетической информации с последовательности нуклеотидов мРНК в последовательность аминокислот в молекуле полипептида. Трансляция осуществляется согласно правилам генетического кода, который имеет следующие особенности:
1. Код – триплетный, т. е. одну аминокислоту определяет три нуклеотида.
2. Код – однозначный (специфичный): каждый кодон обозначает только одну аминокислоту.
3. Код – непрерывный, т. е. отсутствуют сигналы, показывающие конец одного кодона и начало следующего.
4. Код – вырожденный, т. е. одной аминокислоте может соответствовать более одного кодона. Только две аминокислоты – метионин и триптофан – имеют по одному кодону. Лейцину и серину соответствует 6 кодонов, глицину и аланину – по 4 и т. д. Если аминокислота кодируется несколькими кодонами, то в большинстве случаев они различаются по третьей букве, т. е. по нуклеотиду на 3′-конце. Таким образом, специфичность каждого кодона определяется главным образом его первыми двумя нуклеотидами.
5. Код не перекрывается, т. е. один нуклеотид не может одновременно входить в два соседних триплета.
6. Генетический код содержит триплеты, обозначающие начало и окончание синтеза белка. АУГ – инициирующий кодон (кодирует метионин). УАА, УАГ, УГА – терминирующие кодоны, которые не кодируют ни одну из известных аминокислот и сигнализируют об окончании синтеза белка.
7. Генетический код универсален, т. е. одинаков у животных, растений, многих бактерий.
Подготовительные стадии трансляции включают:
- активацию аминокислот;
- присоединение аминокислот к тРНК.
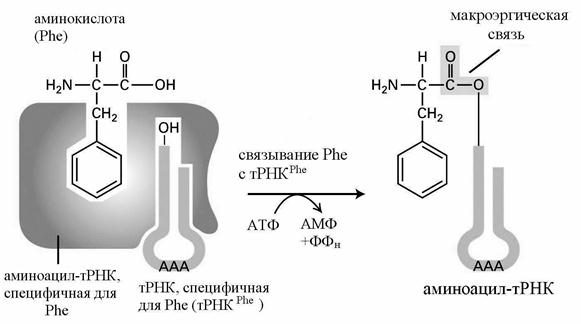 Обе стадии осуществляются с помощью фермента – аминоацил-тРНК-синтетазы (АРС-азы, кодазы). Существует 20 видов таких ферментов – по числу аминокислот. В каждом случае фермент имеет два центра узнавания – для аминокислоты и тРНК (рис. 35).
Обе стадии осуществляются с помощью фермента – аминоацил-тРНК-синтетазы (АРС-азы, кодазы). Существует 20 видов таких ферментов – по числу аминокислот. В каждом случае фермент имеет два центра узнавания – для аминокислоты и тРНК (рис. 35).
Рис. 35. Связывание аминокислоты (фенилаланина – Phe) с тРНК
В активном центре фермента аминокислота связывается с АТФ, лишь затем переносится на тРНК. Образование макроэргической связи между аминокислотой и тРНК называется аминоацилированием, а образовавшийся комплекс – аминоацил-тРНК (аа-тРНК). Каждая тРНК может переносить к месту синтеза белка только одну из аминокислот. Для большей части аминокислот имеется несколько тРНК, которые называются изоакцепторными и обозначаются соответственно тРНК1Phe, тРНК2Phe и т. д.
Собственно процесс трансляции включает три фазы:
- инициацию;
- элонгацию;
- терминацию.
Инициация трансляции – начало синтеза полипептидной цепи, заключается в сборке белоксинтезирующей системы (активной рибосомы).
Функциональные центры рибосом.
Каждая рибосома состоит из двух субчастиц: большой и малой. Форма субчастиц, их контактирующих поверхностей, достаточно сложная (рис. 36). На контактирующих поверхностях большой и малой субчастиц в небольших углублениях находятся центры связывания всех компонентов белоксинтезирующей системы (мРНК, пептидил-тРНК, очередная аминоацил-тРНК), а также центры, катализирующие образование пептидной связи и постепенное перемещение рибосомы относительно мРНК.

Рис. 36. Модель рибосомы Escherichia coli (Васильев В.Д., Институт белка РАН):
слева – перекрывающаяся проекция: малая (30S) субчастица обращена к зрителю
и закрывает собой часть большой (50S) субчастицы; справа – боковая проекция:
к зрителю обращен боковой палочкообразный выступ большой (50S) субчастицы,
а малая (30S) субчастица расположена вверху
Функциональные центры рибосом (рис. 37):
1. 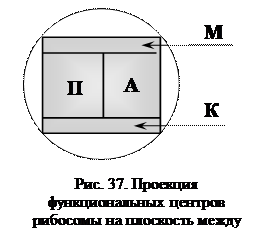 Центр связывания мРНК (М-центр). Образован участком 18S-рРНК, который комплементарен на протяжении 5-9 нуклеотидов 5′-нетранслируемому фрагменту мРНК. Расположен на малой субчастице рибосомы.
Центр связывания мРНК (М-центр). Образован участком 18S-рРНК, который комплементарен на протяжении 5-9 нуклеотидов 5′-нетранслируемому фрагменту мРНК. Расположен на малой субчастице рибосомы.
2. Пептидильный центр (П-центр). В начале процесса трансляции с пептидильным центром связывается инициирующая аа-тРНК. На последующих стадиях трансляции в пептидильном центре находится пептидил-тРНК, содержащая уже синтезированную часть пептидной цепи.
3. Аминоацильный центр (А-центр) – место связывания очередной аа-тРНК. Аминоацильный и пептидильный центры расположены как на большой, так и на малой субчастицах рибосомы.
4. Каталитический (пептидилтрансферазный) центр (К-центр). Катализирует перенос пептидила из состава пептидил-тРНК на поступившую в амино-ацильный центр очередную аа-тРНК. Расположен на большой субчастице рибосомы.
Инициация трансляции у прокариот начинается со связывания мРНК в области 5 - нетранслируемого участка с малой субъединицей рибосомы. Инициирующий кодон (АУГ) оказывается на уровне пептидильного центра будущей рибосомы. Далее за счет комплементарного взаимодействия с этим кодоном происходит связывание инициирующей аа-тРНК. У прокариот инициирующей аа-тРНК является формилметиониновая аа-тРНК – fМet-тРНКi fMet
(рис. 38). Блокирование аминогруппы метионина формильным остатком препятствует включению такой аминокислоты во внутренние участки цепи, но в то же время позволяет fМet-тРНКi fMet связываться с инициирующим кодоном мРНК (АУГ). Инициирующая аа-тРНК, взаимодействуя с пептидильным центром большой субъединицы, вызывает связывание последней.
У прокариот инициация осуществляется при участии трех специфических белков – факторов инициации (IF – I nitiation F actors). IF-3, присоединяясь к малой субчастице рибосомы, препятствует преждевременному связыванию большой субчастицы и, с другой стороны, способствует связыванию мРНК. IF-2 участвует в связывании инициирующей аа-тРНК. Вероятно, этот фактор образует комплекс с аа-тРНК еще вне рибосомы, причем в состав комплекса входит ГТФ. В результате образуется так называемый инициаторный комплекс, состоящий из малой субчастицы рибосомы, мРНК, инициаторной аминоацил-тРНК и факторов инициации (рис. 39). Большая субчастица при ассоциации с малой субчастицей вызывает гидролиз ГТФ (до ГДФ и Фн) и одновременно вытесняет все факторы инициации, включая IF-3. В итоге инициации трансляции образуется полная 70S (у прокариот) рибосома с пептидильнымучастком, занятым инициаторной формилметионил-тРНК, и со свободным аминоацильнымучастком.
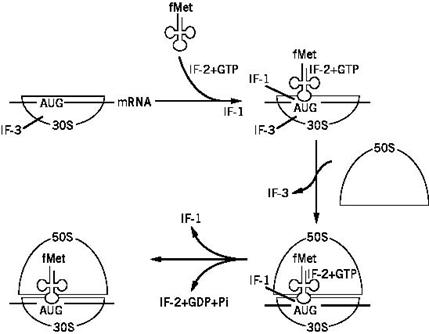
Рис. 39. Инициация трансляции у прокариот
Элонгация трансляции – основной и самый продолжительный этап белкового синтеза, в ходе которого происходит удлинение полипептидной цепи за счет последовательного присоединения аминокислот. Начинается с момента образования первой пептидной связи и заканчивается после включения в полипептидную цепь последней аминокислоты.
Элонгация у бактерий осуществляется при участии трех белковых факторов (EF-Tu, EF-Ts, EF-G) и имеет циклический характер.
Цикл элонгации включает 3 стадии:
1. Связывание аа-тРНК с аминоацильным центром рибосомы. На этой стадии со свободным А-центром рибосомы связывается очередная аа-тРНК – та, чей антикодон комплементарен кодону мРНК, находящемуся в А-центре. Поступив в А-центр, аа-тРНК закрепляется в нем в комплексе с белковым фактором EF-Tu (EF – E longation F actor) и ГТФ. При участии фактора EF-Тu осуществляется гидролиз ГТФ до ГДФ и Фн, а выделяющаяся энергия расходуется на сближение двух аминокислотных остатков. Комплекс EF-Tu·ГДФ при этом покидает рибосому и регенерируется с участием фактора EF-Ts, так что фактор EF-Tu вновь оказывается связанным с молекулой ГТФ (рис. 40).
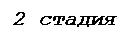 Рис. 40. Этап элонгации в синтезе белка у прокариот
Рис. 40. Этап элонгации в синтезе белка у прокариот
2. Образование пептидной связи. В рибосоме после первой стадии цикла находятся пептидил-тРНК (в П-центре) и аа-тРНК (в А-центре). При этом их акцепторные петли и связанные с ними аминокислотные остатки располагаются в каталитическом (К-) центре. Последний и осуществляет пептидилтрансферазную реакцию: переносит пептидил (или инициирующую аминокислоту – формилметионин у прокариот) на аминокислоту поступившей аа-тРНК. Прежняя тРНК пептидила становится свободной (рис. 40).
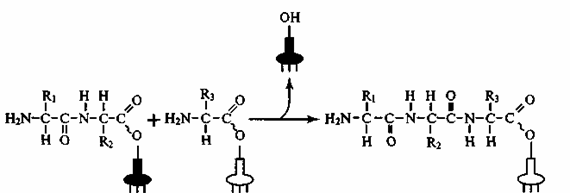
 В ходе пептидилтрасферазной реакции карбоксильная группа пептидила образует пептидную связь с аминогруппой очередной аминокислоты (рис. 41). Таким образом, рост пептидной цепи при трансляции происходит в направлении от N- к С-концу.
В ходе пептидилтрасферазной реакции карбоксильная группа пептидила образует пептидную связь с аминогруппой очередной аминокислоты (рис. 41). Таким образом, рост пептидной цепи при трансляции происходит в направлении от N- к С-концу.
Рис. 41. Пептидилтрансферазная реакция
3. Транслокация – перемещение пептидил-тРНК из А-центра в П-центр в результате передвижения рибосомы по мРНК на один кодон. Свободная тРНК вытесняется из рибосомы, и одновременно освобождается А-центр, необходимый для связывания следующей аа-тРНК. Транслокация идет с участием белкового фактора EF-G (у бактерий) и сопровождается гидролизом одной молекулы ГТФ.
Таким образом, удлинение пептидной цепи на один аминокислотный остаток требует расхода двух молекул ГТФ (одна идет на связывание аа-тРНК, вторая – на траслокацию). Многократное повторение циклов элонгации приводит к включению в строящуюся пептидную цепь аминокислотных остатков в соответствии с последовательностью кодонов в мРНК.
Терминация трансляции. Сигналом об окончании трансляции служит появление в рибосоме одного из терминирующих кодонов мРНК: УАА, УАГ или УГА. С терминирующим кодоном, находящимся в А-центре, взаимодействуют особые белки – факторы терминации, или рилизинг-факторы (от англ. relеase – освобождать). У бактерий в терминации трансляции участвуют три белковых фактора: RF-1, RF-2 и RF-3. Фактор RF-1 узнает кодоны УАА и УАГ, а фактор RF-2 – кодоны УАА и УГА. Фактор RF-3 выполняет вспомогательную роль, стимулируя работу RF-1 и RF-2. При поступлении в рибосому одного из терминирующих кодонов с ним немедленно связывается соответствующий RF-фактор и тем самым блокирует присоединение аа-тРНК. Присоединение факторов терминации стимулирует гидролизную активность пептидилтрасферазного (каталитического) центра, в результате чего связь полипептида с тРНК гидролизуется. Синтезированный белок отделяется от рибосомы, одновременно отделяются тРНК и мРНК, а рибосома диссоцирует на субчастицы (рис. 42).
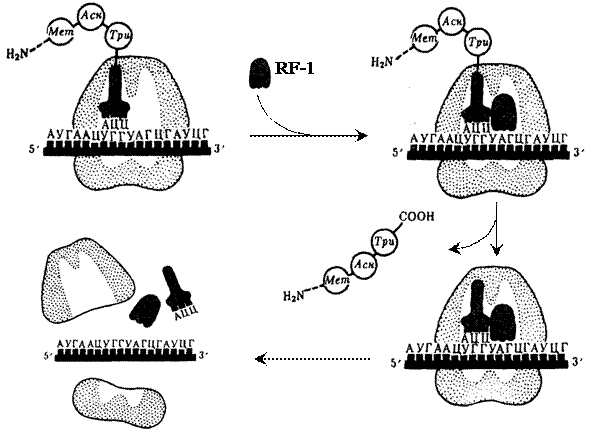 В терминации трансляции принимает участие молекула ГТФ, которая, вероятно, служит аллостерическим регулятором активности белковых факторов терминации.
В терминации трансляции принимает участие молекула ГТФ, которая, вероятно, служит аллостерическим регулятором активности белковых факторов терминации.
Рис. 42. Терминация синтеза пептидной цепи у бактерий
 2013-12-29
2013-12-29 7931
7931
