Пример.
Пример.
Пример.
1. Электродный процесс, уравнение которого Co – 2 e = Co2+, протекает в гальваническом элементе, обозначаемом схемой...
А) Cd│Cd(NO3)2║Co(NO3)2│Co; Б) Co│HBr│Cu; …
Решение.
А) Cd│Cd(NO3)2║Co(NO3)2│Co; в этой схеме слева (Cd│), а не Co│, значит, это неверный ответ.
Б) Co│HBr│Cu; в этой схеме слева Co│, значит, это верный ответ.
2. В гальваническом элементе, обозначаемом схемой Mа│H y An│Mк, протекают электродные процессы, уравнения которых... и
Решение.
Ма – х а е = М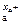 , 2Н+ + 2 е = Н2.
, 2Н+ + 2 е = Н2.
2. В гальваническом элементе, обозначаемом схемой Mn│HI│Fe, протекают электродные процессы, уравнения которых... и
Решение.
Mn – 2 e = Mn2+, 2Н+ + 2 е = Н2.
2. В гальваническом элементе, обозначаемом схемой Mа│соль Mа║соль Mк│Mк, протекают электродные процессы, уравнения которых... и
Решение.
Ма – х а е = М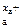 , М
, М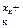 + х к e = Мк
+ х к e = Мк
2. В гальваническом элементе, обозначаемом схемой In│InCl3║CuCl2│Cu, протекают электродные процессы, уравнения которых... и
Решение.
In – 3 e = In3+, Cu2+ + 2 e = Cu.
3. При электрохимической коррозии в нейтральной среде системы «... –...» на катоде образуется частица, формула которой...
Решение.
OH–.
3. При электрохимической коррозии в кислой среде системы «... –...» на катоде образуется частица, формула которой...
Решение.
H2.
3. При электрохимической коррозии в... среде системы «M1 – M2» на аноде образуется частица, формула которой...
Решение.
Надо найти в табл. 3 стандартные потенциалы e 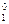 и e
и e 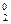 обоих металлов (M1 и M2) и сравнить их между собой. Если e
обоих металлов (M1 и M2) и сравнить их между собой. Если e 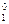 < e
< e 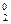 , то на аноде образуется частица, формула которой M
, то на аноде образуется частица, формула которой M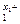 . Если e
. Если e 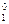 > e
> e 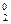 , то на аноде образуется частица, формула которой M
, то на аноде образуется частица, формула которой M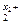 .
.
3. При электрохимической коррозии в... среде системы «Bi – In» на аноде образуется частица, формула которой...
Решение.
Из табл. 3 видно, что e 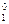 =
= 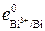 = +0,214 В, e
= +0,214 В, e 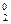 =
= 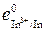 = –0,343 В. Т.к. e
= –0,343 В. Т.к. e 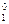 = +0,214 > e
= +0,214 > e 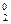 = –0,343, то на аноде образуется частица, формула которой In3+.
= –0,343, то на аноде образуется частица, формула которой In3+.
Таблица 3.
Стандартные потенциалы металлов е 0 при 298 К
| M x + /M | e 0, В | M x + /M | e 0, В | M x + /M | e 0, В | M x + /M | e 0, В |
| Ac3+/Ac | –2,600 | Со2+/Со | –0,277 | La3+/La | –2,522 | Rb+/Rb | –2,925 |
| Al3+/Аl | –1,662 | Сr2+/Cr | –0,913 | Li+/Li | –3,045 | Rh3+/Rh | +0,800 |
| Ag+/Аg | +0,799 | Сu2+/Cu | +0,337 | Mg2+/Mg | –2,363 | Ru2+/Ru | +0,450 |
| Аu3+/Au | +1,498 | Fе2+/Fе | –0,440 | Мn2+/Мn | –1,180 | Sb3+/Sb | +0,240 |
| Ва2+/Ва | –2,906 | Ga3+/Ga | –0,560 | Nа+/Nа | –2,711 | Sc3+/Sc | –2,077 |
| Ве2+/Ве | –1,847 | Н+/Н2 | 0,000 | Ni2+/Ni | –0,250 | Sn2+/Sn | –0,136 |
| Вi3+/Bi | +0,214 | Нg2+/Hg | +0,854 | Рb2+/Pb | –0,126 | Sr2+/Sr | –2,888 |
| Cа2+/Са | –2,864 | In3+/In | –0,343 | Pd2+/Pd | +0,915 | Тl+/Тl | –0,336 |
| Cs+/Сs | –2,923 | Ir3+/Ir | +1,000 | Pt2+/Pt | +0,963 | Y3+/Y | –2,372 |
| Cd2+/Cd | –0,403 | K+/K | –2,924 | Rа2+/Rа | –2,916 | Zn2+/Zn | –0,763 |
4. Формула металла, который может быть получен при электролизе водного раствора его соли с нертутными катодами – это...
Решение.
Это металл, стандартный потенциал которого (см. табл. 3) е 0 > –1,6 В.
4. Формула металла, который не может быть получен при электролизе водного раствора его соли с нертутными катодами – это...
Решение.
Это металл, стандартный потенциал которого (см. табл. 3) е 0 < –1,6 В.
5. При электролизе водного раствора соли на нертутных катодах и инертных анодах выделяются только H2 и An2 (An = Br, Cl, I). Формула этой соли –...
Решение.
Формула этой соли – MAn x, где M – металл, стандартный потенциал которого (см. табл. 3) е 0 < –1,6 В; An = Br, Cl, I.
5. При электролизе водного раствора соли на нертутных катодах и инертных анодах выделяются металл и An2 (An = Br, Cl, I). Формула этой соли –...
Решение.
Формула этой соли – MAn x, где M – металл, стандартный потенциал которого (см. табл. 3) е 0 > –1,6 В; An = Br, Cl, I.
5. При электролизе водного раствора соли на нертутных катодах и инертных анодах выделяются только H2 и S. Формула этой соли –...
Решение.
Формула этой соли – M b S c, где M – металл, стандартный потенциал которого (см. табл. 3) е 0 < –1,6 В.
5. При электролизе водного раствора соли на нертутных катодах и инертных анодах выделяются только H2 и O2. Формула этой соли –...
Решение.
Формула этой соли – M b An c, где M – металл, стандартный потенциал которого (см. табл. 3) е 0 < –1,6 В; An = AsO4, CO3, ClO4, F, PO4, NO3, SO4, SeO4.
5. При электролизе водного раствора соли на нертутных катодах и инертных анодах выделяются металл и O2. Формула этой соли –...
Решение.
Формула этой соли – M b An c, где M – металл, стандартный потенциал которого (см. табл. 3) е 0 > –1,6 В; An = AsO4, CO3, ClO4, F, PO4, NO3, SO4, SeO4.
СОДЕРЖАНИЕ
Химическая кинетика и равновесие...............................1
Реакции в растворах электролитов.................................5
ОВР....................................................................................9
Основы электрохимии....................................................13
 2013-12-28
2013-12-28 774
774








