Растения
Анкета для опроса реализаторов фруктовой продукции
Анкета для опроса производителей фруктовой продукции
1. Какую фирму (предприятие) Вы представляете? ______________________________________________________________
2. Производством каких фруктов Вы занимаетесь?
| Садово-ягодные | |
| Цитрусовые | |
| Экзотические | |
| Другие |
3. В каких торговых структурах происходит реализация Вашей продукции?
| Торговая структура | %-е распределение |
| Супермаркет | |
| Минимаркет | |
| Магазин | |
| Киоск | |
| Рынок |
4. Планируете ли Вы внедрение новых технологий в производство? _________
5. Какую часть Вы занимаете в отрасли производства фруктовой продукции в процентном выражении?____________________________________________
6. Обеспечиваете ли Вы рекламу вашей продукции? Если да, то какими способами?
| Дегустации | |
| Ярмарки | |
| Выставки | |
| Бигборды | |
| Реклама в СМИ | |
| Другие виды рекламы |
7. Планируете ли Вы изменение ассортимента продукции в будущем? ________
1. Какой ассортимент фруктовой продукции имеется у Вас для реализации?
| Отечественные | Зарубежные | ||
| Название | Оценка | Название | Оценка |
| Яблоко | Банан | ||
| Виноград | Апельсин | ||
| Персик | Мандарин | ||
| Абрикос | Гранат | ||
| Вишня | Финик | ||
| Груша | Киви | ||
| Слива | Грейпфрут | ||
| Другие | Другие |
2. Каков объем продаж фруктовой продукции за неделю (%-е распределение ассортимента по количеству продаж)
| Отечественные | Зарубежные | ||
| Название | % | Название | % |
| Яблоко | Банан | ||
| Виноград | Апельсин | ||
| Персик | Мандарин | ||
| Абрикос | Гранат | ||
| Вишня | Финик | ||
| Груша | Киви | ||
| Слива | Грейпфрут | ||
| Всего | Всего |
3. В какое время года покупатели чаще приобретают фруктовую продукцию? Ответьте, используя процентное распределение.
| Время года | % |
| Весна | |
| Лето | |
| Осень | |
| Зима |
4. Каким спросом пользуются разные виды фруктов? (расставьте цифры от 1 до 7, в зависимости от популярности вида)
| Отечественные | Зарубежные | ||
| Название | Оценка | Название | Оценка |
| Яблоко | Банан | ||
| Виноград | Апельсин | ||
| Персик | Мандарин | ||
| Абрикос | Гранат | ||
| Вишня | Финик | ||
| Груша | Киви | ||
| Слива | Грейпфрут |
5. Продукцию какого ценового диапазона покупают чаще всего (цена в грн./кг)?
| 1,50 – 3,0 | |
| 3,50 – 5,0 | |
| 5,50 – 9,50 | |
| 10 и выше |
Конечным результатом ПГК у животных является разрушение клеток с образованием апоптозных везикул, фагоцитируемых макрофагами и клетками-соседями. Апоптоз у животных приводит к исчезновению клетки. У растений дело обстоит иначе (Самуилов, 2001). Во-первых, жесткая клеточная стенка растений предотвращает фагоцитоз, поэтому у растений отсутствуют специализированные клетки, предназначенные для фагоцитоза. Во-вторых, итоговая картина апоптоза в значительной мере зависит от вида ткани. Вместо самоуничтожения на основе погибших клеток зачастую создаются конструкции, жизненно важные для растений.
Изменения в морфологии клеток растений при апоптозе сходны с изменениями клеток животных. Также наблюдаются конденсация хроматина и дробление ядра, протопласт сжимается, цитоплазматическая мембрана образует складки, в клетку устремляется поток Ca2+, в наружном монослое плазматической мембраны появляется фосфатидилсерин, происходит олигонуклеосомальная фрагментация ядерной ДНК. Происходит также разрыв плазмодесм – мембранных каналов, соединяющих протопласты соседних клеток, чтобы инфекция не распространялась из зараженной клетки в соседние. Апоптозные везикулы, образующиеся путем дробления протопласта, у растений в отличие от животных выявляются не всегда. У растений нет особой необходимости в образовании апоптозных везикул, поскольку, как уже отмечалось, отсутствуют специализированные клетки-фагоциты и фагоцитозу препятствует клеточная стенка. Поэтому содержимое протопласта разрушается с помощью гидролитических ферментов, а мономерные остатки разрушенных клеток утилизируются соседними клетками. Другой вариант заключительного этапа клеточной гибели – при поражении патогенным возбудителем образуется отторгающая ткань, возникает перидерма, отгораживающая очаг инфекции.
Рассмотрим особенности механизмов инициации и реализации апоптоза у
растений. Инициация апоптоза может вызываться как вне-, так и внутриклеточными сигналами (рис. 6) (Киселевский и др., 2006).
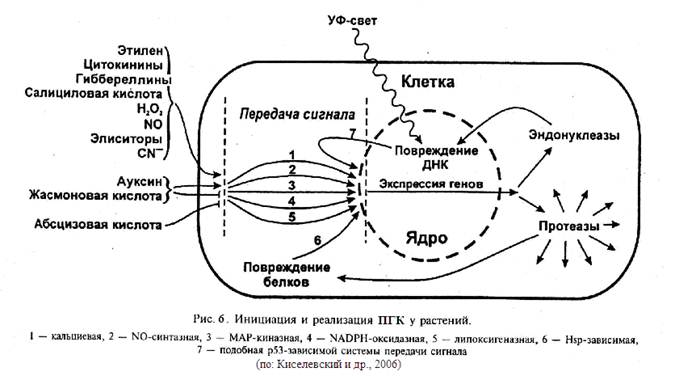
Рассмотрим для начала внеклеточные индукторы апоптоза растений. Фитогормон этилен участвует в опадании листьев, созревании и опадании плодов. Обработка этиленом вызывала гибель клеток эндосперма злаковых и формирование аэренхимы в корнях кукурузы. У мутантов Arabidopsis thaliana экзогенный этилен усиливал АФК- и токсининдуцированную ПГК. При этом наблюдалось усиление генерации АФК. По своим признакам этилен-индуцированная смерть клеток (межнуклеосомная фрагментация ДНК, образование апоптозных телец) соответствует апоптозу. В клетках A. thaliana обнаружено пять различных этиленовых рецепторов, расположенных трансмембранно. Передача сигнала происходит, вероятно, с помощью МАР-киназного (mitogen-activated protein kinase) каскада.
Цитокинины подавляют пролиферацию клеток и индуцируют ПГК. Цитокинин N6-бензиламинопурин вызывал программируемую гибель клеток моркови и A. thaliana, детектируемую по конденсации хроматина, олигонуклеосомной деградации ДНК и выходу из митохондрий в цитоплазму цитохрома с. Действие цитокининов может быть связано с активацией ими синтазы 1-аминоциклопропан-1-карбоновой кислоты, являющейся предшественником этилена, хотя возможно наличие иных путей регуляции ПГК цитокининами.
Ауксин стимулировал ПГК в проростках табака. Ингибитор транспорта ауксина в клетки 2,3,5-трийодобензоат подавлял гибель клеток. Наблюдалась ауксинзависимая фрагментация ядерной ДНК. Предполагается, что действие ауксина связано с активацией синтеза этилена, поскольку ингибиторы синтеза этилена AgNO3 и аминооксиацетат предотвращали ПГК в проростках. Однако ауксин подавлял олигонуклеосомную фрагментацию ДНК в клетках моркови, индуцированную цитокинином, а также предотвращал активацию индуцированного Н2О2 МАР-киназного каскада в клетках листьев A. thaliana, способствующего запуску ПГК.
Абсцизовая кислота — регулятор развития эндосперма злаковых. Наблюдается стимуляция ПГК в эндосперме мутантов кукурузы, нечувствительных к абсцизовой кислоте или синтезирующих ее в низких концентрациях. Предполагается, что баланс между абсцизовой кислотой и этиленом регулирует инициацию ПГК в эндосперме. Абсцизовая кислота защищает клетки отПГК при формировании пыльника у ячменя в андрогенезе, предотвращает гибель клеток и олигонуклеосомную фрагментацию ДНК вызванную обработкой цитокинином. При прорастании семян ПГК алейроновых клеток индуцируется гиббереллином, тогда как абсцизовая кислота подавляет клеточную гибель. Показано, что эта фитогормональная регуляция опосредована АФК. Вероятно, гиббереллин снижает антиоксидантную защиту клеток растений.
Жасмоновая кислота является сигнальным соединением, синтезирующимся при ГО. Жасмоновая кислота и метилжасмонат — конечные продукты липоксигеназного сигнального пути. Жасмоновая кислота стимулирует гибель протопластов A. thaliana, вызванную грибным токсином фумонизином B1. Однако метилжасмонат ингибирует озониндуцированную ПГК у мутантов A. thaliana. Предполагается, что жасмоновая кислота снижает продукцию АФК, индуцированную озоном. Таким образом, жасмонат в различных условиях может быть как позитивным, так и негативным регулятором программируемой гибели.
Салициловая кислота, как и индуцирующий ее образование Н2О2, является одним из главных сигнальных соединений при ГО. Выявлено, что одна из двух МАР-киназ, вовлеченных в ГО клеток табака, индуцируется салициловой кислотой. Показана аккумуляция салициловой кислоты в клетках, окружающих место заражения патогеном. У трансгенных растений, не синтезирующих салицилат, снижался уровень гибели клеток, индуцируемой Оз или элиситорами патогенов. ПГК, индуцированная токсином гриба фумонизином В1, опосредована накоплением в клетках салициловой кислоты. Интересно, что салициловая кислота является ингибитором каталазы и пероксидаз, обеспечивающих защиту клетки от АФК.
Элиситоры — сигнальные молекулы различной природы, индуцирующие ПГК при ГО. В основном это вещества, входящие в состав клеточной стенки, мембран патогена или экскретируемые патогенными бактериями и грибами. Белки оболочки отдельных вирусов тоже обладают элиситорными свойствами. Элиситоры могут образовываться при ферментативном расщеплении кутикулы и полисахаридов клеточных стенок самих растений. К элиситорам относятся арахидоновая и эйкозапентаеновая кислоты, хитозаны, элиситины (небольшие пептиды, продуцируемые Phytophthora и Pythium, например криптогеин), харпины (бактериальные белковые элиситоры), декстрины, называемые олигосахаринами (продукты гидролиза клеточных стенок растения, состоящие из нескольких остатков глюкозы).
CN- не является чужеродным для растений. Многие растения (клевер, вишня, слива, маниок и др.) содержат цианогенные гликозиды, защищающие их от фитопатогенов. У растений CN- может образовываться при деградации цианогенных гликозидов и при окислении 1-аминоциклопропан-1-карбоновой кислоты на конечном этапе биосинтеза этилена, при этом образуются этилен, HCN и СО2. Цианид ингибирует гемопротеины. В клетках растений CN- подавляет фотосинтетический и дыхательный (с участием цитохромоксидазы) перенос электронов, снижает активность каталазы и пероксидаз — ферментов, осуществляющих деградацию Н2О2. CN- вызывает ПГК у растений.
Сигналы, запускающие ПГК, поступают не только извне. Так, необратимые нарушения вторичной структуры белков клетки инициируют программу гибели. Денатурация белков вызывается тепловым, окислительным и солевым воздействиями, тяжелыми металлами, мутациями и нарушениями в системе экспрессии генов. Появление в клетке денатурированных белковых молекул активирует синтез особых белков — белков теплового шока (Hsp, heat shock proteins), к которым относят шапероны — семейство белков, восстанавливающих структуру денатурированных белков клетки. Нарушение вторичной структуры белков в клетке вызывает образование их комплексов с Hsp — шапероны восстанавливают правильную пространственную укладку белковых молекул. В связанном состоянии Hsp не могут подавлять апоптоз, и клетка погибает. Тепловой шок у растений запускает ПГК. ПГК, вызванная тепловой обработкой клеток табака, сопровождается усилением генерации АФК. При этом в клетках уменьшается активность аскорбатпероксидазы и нарушается работа митохондриальной электрон-транспортной цепи. Белки теплового шока предотвращают деградацию клеток растений и их компонентов. Снижение экспрессии гена белка Hsp 70, локализованного в хлоропластах одноклеточной водоросли хламидомонады, повышало чувствительность фотосистемы II к разрушительному действию интенсивного света, а сверхэкспрессия защищала ФС II от фотоингибирования. Мутация хлоропластного шаперонина 60β у A. thaliana вызывала ПГК.
Нарушения структуры ДНК, например при УФ-облучении, вызывают ПГК у растений. Ультрафиолет индуцирует ПГК у A. thaliana, при которой наблюдается олигонуклеосомная фрагментация ДНК и участие каспазоподобных протеаз.
Идентифицированы системы, передающие сигнал в ядро клетки, что вызывает активацию факторов транскрипции и экспрессию генов. Выявлено участие аденилатциклазной, МАР-киназной, фосфатидной, кальциевой, липоксигеназной, NADPH-оксидазной, NO-синтазной, зависимой от Н+-помп сигнальных систем при ГО. Очевидно, в той или иной степени эти системы задействованы в ПГК. Считается, что наиболее важную роль в ПГК у растений играют кальциевая, липоксигеназная, NADPH-oксидазная, NO-синтазная и МАР-киназная системы (рис. 7).
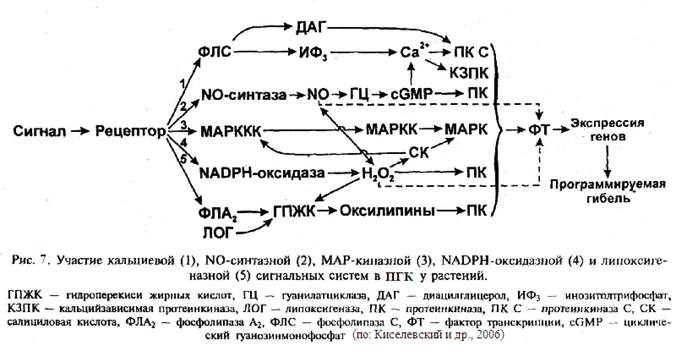
Кальциевая сигнальная система активируется при повышении концентрации Са2+ в цитоплазме. Поступающий в клетку сигнал воспринимается рецептором. Связанный с ним регуляторный G-белок активирует фосфолипазу С, которая катализирует гидролиз фосфатидилинозитол-4,5-дифосфата в плазматической мембране с образованием диацилглицерола и инозитол-1,4,5-трифосфата. Инозитолтрифосфат вызывает мобилизацию Са2+ из внутриклеточных депо и из межклеточного пространства в цитоплазму. Накопление Са2+ в цитоплазме может стимулироваться АФК. Са2+ влияет на активность различных белков: у A. thaliana обнаружено около 250 белков, имеющих хотя бы одну Са2+-связывающую аминокислотную последовательность. Диацилглицерол и повышение концентрации Са2+ активирует протеинкиназу С, которая наряду с Са2+-зависимыми протеинкиназами вызывает активацию факторов транскрипции и экспрессию генов, инициирующих ПГК.
Действие липоксигеназной сигнальной системы характеризуется окислением полиненасыщенных жирных кислот. Различные сигналы активируют фосфолипазу А2, катализирующую высвобождение жирных кислот из мембранных фосфолипидов. Ненасыщенные жирные кислоты являются субстратами для α-диоксигеназы, пероксидаз и липоксигеназ, окисляющих их. Окисление жирных кислот может осуществляться АФК. В результате окисления образуются гидроперекиси жирных кислот. Некоторые из них (оксилипины, например фитопростан, α-кетол, γ-кетол, травматиновая кислота, фитодиеновая кислота) играют роль клеточных метаболитов, регулирующих экспрессию генов. Из фитодиеновой кислоты могут синтезироваться жасмоновая кислота и метилжасмонат.
Основным метаболитом NADPH-оксидазного сигнального пути, включающегося, например, при ГО, является Н2О2. При ГО запускается каскад реакций (рис. 8), приводящий к гибели клетки, а также к образованию сигнальных соединений (Н2О2, салициловая кислота), активирующих различные защитные процессы в соседних клетках. Этот каскад включает вход в клетку Са2+ и Н+ и выход К+ и С1-.
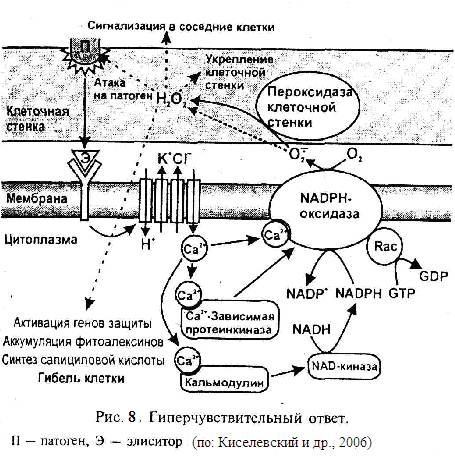
Увеличение концентрации Са2+ в цитоплазме клетки вызывает активацию NADPH-oксидазы плазматической мембраны. Большая субъединица NADPH-оксидазы имеет две регуляторные Са2+-связывающие аминокислотные последовательности. Кроме того, существует непрямая активация кальцием NADPH-оксидазы: Са2+ активирует кальций-зависимую протеинкиназу (CDPK), индуцирующую NADPH-оксидазу; Активация NADPH-оксидазы вызывает образование АФК — супероксидного аниона-радикала (O2-*) и Н2О2. Образование Н2О2 может идти и при участии пероксидазы клеточной стенки. При этом снижается экспрессия генов ферментов, утилизирующих Н2О2 — аскорбат-пероксидазы и каталазы. Н2О2 при ГО действует как сигнальное соединение, вызывающее гибель клеток растений и экспрессию генов устойчивости к патогену, как антисептик по отношению к патогену и как соединение, вызывающее упрочнение клеточных стенок в месте заражения (механический барьер для патогена, препятствующий его проникновению). Увеличение прочности клеточных стенок происходит за счет окисления пероксидом остатков тирозина в белках клеточной стенки и остатков фенольных соединений, входящих в состав лигнина, что вызывает их перекрестную сшивку. NADPH-оксидазная сигнальная система тесно связана с кальциевой и МАР-киназной системами передачи сигнала. Возможна непосредственная регуляция различных ферментов и факторов транскрипции пероксидом водорода. Окисление SH-гpyппы остатка цистеина с помощью O2-* или Н2О2 может приводить к изменению конформации, образованию дисульфидных мостиков и сшивке белков. Обычно такие изменения переводят ферменты в неактивное состояние, но есть белки, активность которых повышается при окислении. Важную роль в NADPH-оксидазном сигнальном пути играет салициловая кислота, ее концентрация в клетке при действии элиситоров или Н2О2 возрастает в десятки раз.
NO, образующийся из аргинина при активации NO-синтазы элиситорами патогенов, может играть роль сигнальной молекулы, вызывая синтез фитоалексинов и защитных белков. Предполагается, что передача сигнала в ядро происходит при активации оксидом азота гуанилатциклазы, которая катализирует образование cGMP из GTP. cGMP может активировать кальциевые каналы, повышая концентрацию Са2+ в цитоплазме, а также являться индуктором некоторых протеинкиназ, регулирующих экспрессию генов. NO способен нитрозилировать глутатион, низкомолекулярный антиоксидант, и различные белки. S-нитрозилирование глутатиона и белков может регулировать активность клеточных ферментов и транскрипцию генов. Оксид азота способен влиять на активность редокс-чувствительных факторов транскрипции и ряда ферментов. Фосфорилирование является наиболее универсальным механизмом передачи сигнала в ядро клетки.
МАР-киназная сигнальная система представляет собой каскад последовательно активирующихся протеинкиназ. Активация МАР-киназ коррелирует с образованием Н2О2. Каскад МАР-киназ запускается индукторами ПГК у растений (элиситорами различной природы, АФК, УФ-светом, солевым и тепловым шоком, салициловой кислотой, этиленом, ауксином). Геном A. thaliana кодирует около 20 различных МАР-киназ. Каскад МАР-киназ регулируется фосфатазами. МАР-киназы активируются при фосфорилировании остатков треонина и тирозина. Фосфатазы, катализируя дефосфорилированке МАР-киназ, деактивируют их.
Важную роль в ПГК у растений играют митохондрии. Многие считают их
центральными органеллами, реализующими ПГК. Митохондрии — АФК-генерирующие структуры. 1—3% электронного потока в митохондриях может быть мобилизовано на одноэлектронное восстановление О2 с образованием О2-*. В образовании АФК участвуют комплексы I и III дыхательной цепи. При апоптозе образование АФК в митохондриях существенно усиливается. В отличие от митохондрий животных, митохондрии растений имеют возможность устойчивого к ротенону переноса электронов с NAD(P)H, находящегося в матриксе или межмембранном пространстве, на убихинон, а также у них существует альтернативная оксидаза, осуществляющая перенос электронов с убихинона на 02. Несмотря на различия в структуре, митохондрии растений, подобно митохондриям животных, способны генерировать АФК. Зарегистрировано усиление митохондриального транспорта электронов и генерации АФК при ПГК у A. thaliana, вызванной окислительным стрессом. АО является антиоксидантным ферментом — повышение уровня АФК в клетках растений стимулирует перенос электронов с участием АО. Активация АО предотвращала программируемую гибель клеток табака. Митохондрии — источники факторов, индуцирующих ПГК. Менадион (АФК-генерирующий агент) вызывал высвобождение цитохрома с из митохондрий в цитозоль и гибель протопластов табака. Наблюдались нарушение проницаемости митохондриальной мембраны (открытие РТР) и выход цитохрома с при ПГК у A. thaliana, вызванного Н2О2. Высвобождение цитохрома с из митохондрий происходило при гарпин-индуцированной гибели культуры клеток A. thaliana. Токсин викторин стимулировал открытие РТР-пор в клетках овса. NO индуцировал ПГК, сопровождающуюся падением митохондриального мембранного потенциала у растений, которое предотвращалось циклоспорином А — ингибитором образования РТР. Озон вызывал выход цитохрома с из митохондрий клеток табака, активацию протеаз и фрагментацию ДНК. Мутация у подсолнуха индуцировала высвобождение цитохрома с в цитоплазму, происходившее до характерных морфологических изменений в клетках. Тем не менее пока остается неясно, является ли высвобождение цитохрома с ключевым событием в ПГК у растений, запускающим гибель клеток, или же это — лишь результат деградации митохондрий в конечной стадии ПГК. В межмембранном пространстве митохондрий растений локализуется Mg2+-зависимая эндонуклеаза, осуществляющая разрезание ядерной ДНК на фрагменты длиной ~ 30 тыс. п.н. Эта эндонуклеаза, по-видимому, является аналогом эндонуклеазы G. Гомологи белков семейства Bcl-2 у растений не найдены, однако экспрессия гена белка Вах, вызывающего образование РТР, стимулирует ПГК, фенотипически сходную с гибелью клеток при ГО. Экспрессия генов антиапоптозных белков Bсl-2 и BcI-xL у табака предотвращала гербицид-индуцированную ПГК. Отмечена накопление этих белков в митохондриях и хлоропластах.
Возможно также участие и хлоропластов в ПГК у растений. Хлоропласты имеют собственный геном, кодирующий ~ 100 белков (в основном белки фотосинтетического аппарата, систем транскрипции и трансляции). Другие белки хлоропластов (всего их около 3000) кодируются ядерным геномом. По структуре и функциям хлоропласты достаточно близки к митохондриям. Логично предположить, что они, по аналогии с митохондриями, могут играть важную роль в ПГК. Хлоропласты являются источниками активных форм кислорода, причем образование АФК в них значительно выше, чем в митохондриях. Синглетный кислород 1О2 образуется в хлоропластах на свету — возбужденный хлорофилл, переходя в триплетное состояние, может взаимодействовать с кислородом, образуя 1О2. Порфириновые интермедиаты, образующиеся при биосинтезе хлорофилла, и продукты распада хлорофилла обладают свойствами фотосенсибилизаторов, способных генерировать АФК в клетках. O2-* образуется при одноэлектронном восстановлении кислорода компонентами ЭТЦ хлоропластов, преимущественно ФС I (Fe-S-центрами Fx,a,b) - кроме того, образование O2-* может идти при участии ферредоксина и ферредоксин-NADP+ редуктазы. На восстановление 02 до O2-* может быть мобилизовано до 30% электронного потока в ЭТЦ хлоропластов. АФК, генерируемые в хлоропластах на свету, активируют экспрессию генов антиоксидантноЙ защиты клеток. Также показано, что редокс-состояние пластохинона ЭТЦ хлоропластов регулирует экспрессию генов путем активации протеинкиназ. Структурное и функциональное сходство хлоропластов с митохондриями, высокая способность к образованию АФК и светозависимая регуляция экспрессии ядерных генов — предпосылки значимой роли хлоропластов в ПГК. Хотя в настоящее время нет прямых доказательств, имеются некоторые косвенные подтверждения того, что хлоропласты участвуют в ПГК. Мутация (делеция) в гене шаперонина 60β белка хлоропластов, вызывала программируемую гибель клеток в листьях A. thaliana. Снижение уровня хлоропластного белка DS9, гомолога бактериальной металлопротеазы FtsH, приводило к ускорению ГО и ассоциированной с ним программируемой гибели клеток листьев табака, инфицированного вирусом табачной мозаики. Мутации по копропорфириноген-III-оксидазе и редуктазе "красного" катаболита хлорофилла, ведущие к нарушению биосинтеза гема и хлорофилла, деградации хлорофилла и накоплению соединений порфириновой природы, инициируют ПГК в листьях растений, предположительно опосредованную генерацией АФК при окислении фотовозбужденных порфириновых соединений кислородом. В некоторых работах отмечено, что освещение усиливает ПГК у растений. Очевидно, светозависимость ПГК обусловлена участием хлоропластов. Свет усиливал CN--индуцированную гибель устьичных клеток гороха, но не эпидермальных клеток, не имеющих хлоропластов. Ингибиторы фотосинтеза подавляли световую стимуляцию ПГК, опосредованную, вероятно, ФС II. Предположительно, участие хлоропластов в ПГК было опосредовано АФК и редокс-сострянием пластохинона. УФ-облучение вызывало гибель клеток растений, усиливавшуюся при экспозиции на видимом свету. Гибель протопластов A. thaliana, вызванная токсином фумонизином В1, усиливалась при освещении. Свет индуцировал спонтанную гибель протопластов мутанта acd2. Предполагается, что освещение активировало светозависимую фенилаланин-аммиаклиазу — фермент системы синтеза салициловой кислоты, индуцирующей ПГК. Биосинтез салициловой кислоты осуществляется в хлоропластах. Мутация гена lls1, экспрессируемого в фотосинтезирующих тканях, вызывала светозависимую гибель клеток мезофилла в листьях кукурузы. Предполагается, что ПГК была опосредована АФК, образующимися в хлоропластах. Белок LLS1, продукт гена lls1, подавлял гибель клеток, индуцированную биотическими и абиотическими факторами. Так, предполагаемый вклад хлоропластов в ПГК заключается в генерации ими АФК, регуляции синтеза салициловой кислоты, участии некоторых хлоропластных белков (шаперонин 60β, DS9 и LLS1) и, возможно, регуляции ПГК редокс-состоянием пластохинона.
Главным орудием ПГК у животных являются цистеиновые протеазы, называемые каспазами (Самуилов, 2001). Применительно к растениям нет прямых данных об участии каспаз в ПГК, но имеются косвенные указания, полученные со специфическими тетрапептидными ингибиторами каспаз. Добавление таких ингибиторов вызывает подавление ПГК у растений. Экспрессия цистатина, гена эндогенного ингибитора цистеиновых протеаз, подавляет апоптоз у клеток сои. Подобные эффекты не наблюдаются при синтезе белковых ингибиторов сериновых протеаз. ПГК не является единственной сферой действия цистеиновых протеаз у растений. Они участвуют в катаболизме запасных белков эндосперма в зерне у злаков. Так, в проростках ячменя цистеиновые протеазы ответственны за гидролиз запасных белков гордеинов до пептидов. С участием цистеиновых протеаз происходит заселение бобовых растений клубеньковыми бактериями.
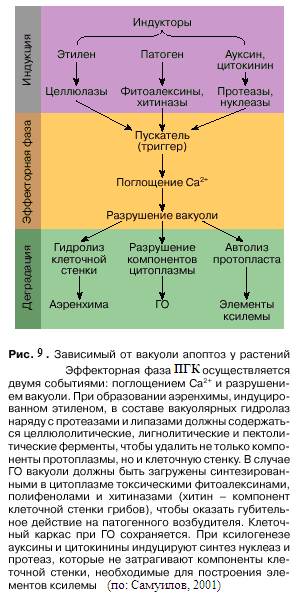
Большую роль в реализации апоптоза у растений играет вакуоль. Вакуоль претерпевает значительные изменения при старении листьев и ГО, в процессе дифференцировки элементов ксилемы и образования аэренхимы. При этом происходят поглощение Ca2+, разрыв тонопласта и разрушение вакуоли с одновременной остановкой движения цитоплазмы. Судьба погибшей клетки зависит от природы вакуолярных гидролаз (рис. 9). Этими гидролазами, предварительно синтезированными на рибосомах цитоплазмы, вакуоли загружаются после поступления в клетку соответствующего апоптозного сигнала. Содержимое вакуоли определяет картину дезинтеграции погибшей клетки и функциональную предназначенность ПГК.
Рассмотрим теперь значение апоптоза для растений. Апоптоз задействован при индивидуальном развитии растений. Прорастание пыльцевой трубки осуществляется в результате гибели клеток на пути ее прорастания, зависит от видовой принадлежности пыльцы и не включается при действии чужеродной пыльцы. При прорастании семян алейроновые клетки секретируют ферменты, катализирующие гидролиз запасных полимеров эндосперма, и обеспечивают тем самым питание проростка. Будучи ненужными для последующего развития, алейроновые клетки погибают по завершении прорастания. Клетки корневого чехлика защищают меристему корня при его росте. Программа гибели этих клеток включается даже при выращивании растений гидропонным способом. Очертания
-23-
листьев у многих растений, по-видимому, формируются через механизм ПГК. Так, места перфораций, наличие лопастей у листьев растений из сем. Аронниковые определяются зонами гибели клеток на ранних стадиях развития. Элементы сосудов ксилемы — это останки специализированных клеток, дифференцировка которых может быть вызвана фитогормонами (комбинацией ауксина и цитокинина) или механическим травмированием растения. Дифференцировка состоит в удлинении клеток, значительном (вторичном) утолщении клеточных стенок и их лигнификации для придания прочности и жесткости. Конечный этап дифференцировки — клеточная смерть. Вначале разрывается тонопласт — мембрана вакуоли, содержащей гидролитические ферменты. Вслед за этим подвергаются автолизу ядро и клеточные органоиды. Исчезают также торцевые части клеточных стенок, и из отдельных оставшихся цилиндрических элементов клеточных стенок, расположенных последовательно, у интактных растений формируются длинные трубки проводящей системы. Опадание листьев и созревших плодов сопровождаются избирательной гибелью клеток отделительной зоны, расположенной между основанием черешка листа или плода и стеблем, которая активируется благодаря экспрессии sag -генов. Клетки в отделительном слое секретируют ферменты, разрушающие клеточные стенки (пектиназы и целлюлазы). Локально действуя на определенный участок, ферменты частично растворяют клеточные стенки в отделительном слое, а сами клетки отделительного слоя подвергаются автолизу, клеточные полимеры распадаются, и черешок отваливается от стебля.
Апоптоз задействован и в иммунных реакциях на патоген. Устойчивость растения к патогену определяется способностью распознать его и своевременно включить механизм защиты. Наряду с индукцией синтеза фитоалексинов (растительных антибиотиков) и гидролитических ферментов, растворяющих полимерные соединения патогена, в частности хитиназы, к таким механизмам относятся активация в инфицированных клетках и клетках, локализованных вблизи очага инфекции, программы собственной гибели — процесс, называемый гиперчувствительным ответом. Образуется зона мертвых обезвоженных клеток, которая служит барьером для дальнейшего распространения патогена.
Апоптоз задействован также при нейтрализации последствий стрессорных воздействий. В природных условиях на растения оказывают влияние разнообразные физико-химические факторы. Наиболее чувствительны к этим воздействиям белки, подвергающиеся денатурации. Если денатурированных белков в клетке образовалось много и жизнедеятельность клетки вследствие этого не может быть продолжена, включается механизм апоптоза со всеми признаками, характерными для этого процесса. Апоптоз продемонстрирован при различных воздействиях, включая засоление, УФ-облучение, отравление цианидом. Особого рассмотрения заслуживает ПГК при затоплении растений, когда возникают трудности с доставкой кислорода. Образуется специальная ткань, называемая аэренхимой. Это адаптивная реакция растений на дефицит кислорода, заключающаяся в образовании полостей в корнях и у основания стебля, заполненных воздухом, за счет элиминации некоторых клеток с полным разрушением клеточных стенок с участием
активирующихся гидролитических ферментов.
 2013-12-31
2013-12-31 982
982








