Прокариоты
Наиболее распространенным типом ПГК у прокариот является автолиз (Lewis, 2000). Автолиз - это гибель клетки в результате разрушения клеточной стенки пептидогликановыми гидролазами, называемыми автолизинами. Как синтез, так и
-25-
гидролиз пептидогликана необходимы для построения клеточной стенки, и по крайней мере часть автолизинов участвует в этом процессе. Поэтому традиционно автолиз рассматривали как результат разбалансировки конструктивных и деструктивных процессов. однако появилось множество фактов, указывающих на то, что автолиз является программируемой гибелью бактерий.
На первый взгляд, дефектному одноклеточному организму невыгодно совершать самоубийство. Но, принимая во внимание выявленные у бактерий внутрипопуляционные связи, делающие их колонии похожими на многоклеточные организмы, уже нетрудно понять, почему у прокариот все-таки существует ПГК.
Заметная часть клеток в популяции симбиотической бактерии Fibrobacter succinogenes лизируется на логарифмической стадии роста, снабжая своего хозяина белковой пищей. Однако, в отсутствие питательных веществ (сахаров), например, в период голодания хозяина, автолиз прекращается за счет синтеза протеазы, расщепляющей автолизины. У множества видов бактерий автолиз участвует в процессе генетической трансформации. Высвобожденная в результате лизиса части клеточной культуры свободная ДНК поглощается затем нелизировавшимися клетками. Автолиз происходит также в ответ на действие антибиотиков и других повреждающих факторов.
Однако, ПГК имеет и обратную сторону медали - а что если антибиотик, вызывающий автолиз, диффундирует ко всем клеткам популяции? Очевидно, тогда все они погибнут, что ставит под сомнение ценность ПГК. Но Природа придумала на этот случай защитный механизм. В любой бактериальной популяции всегда имеется небольшое число (1/1000000 часть) клеток, неспособных совершать ПГК в ответ на воздействие повреждающих агентов, в частности антибиотиков. Особенно много таких клеток в биопленках. Однако, это не мутанты - их рост ингибируется антибиотиками, а их потомство не является более устойчивым к ним. Одна из гипотез, обьясняющих феномен "персистентов", заключается в следующем. Число регуляторных молекул одного вида в бактериальной клетке может быть очень мало, например, всего 10 молекул LacI репрессора на клетку у E. coli. Если какой-либо регулятор ПГК представлен в клетках в столь же малых количествах, то разброс конкретных значений количества молекул в клетке в популяции должен порождать небольшое число особей, дефицитных по ПГК.
Еще одной проблемой, связанной с наличием ПГК, является проблема вытеснения популяций "альтруистов", обладающих ПГК, популяциями "эгоистов", мутантов с нарушенной ПГК. Чтобы этого не происходило, в Природе поддерживается низкий уровень мутаций. Для этого все клетки, не сумевшие исправить поврежденную ДНК, подвергаются автолизу. Кроме того, существует опастность внедрения популяций "эгоистов" в популяции "альтруистов" при случайной встрече. Тогда "эгоисты", получая все преимущества жизни среди "альтруистов", не будут элиминированы естественным отбором, как если бы они образовали отдельную колонию. Решением этой проблемы является несовместимость клонов - между ними всегда остается "нейтральная зона". Кроме того, колонии часто покрывают
себя слоем полисахарида и образуют биопленки, в которые черезвычайно трудно внедриться.
Низкий уровень мутаций черезвычайно важен также для того, чтобы не происходило вытеснения нормальных клеток мутантными во время стационарной фазы. Мутанты, размножающиеся быстрее обычных клеток во время стационарной фазы, при наступлении благоприятных условий становяться неконкурентоспособными и погибают, уступая место другим клонам. Помимо низкого уровня мутаций для решения этой проблемы существует и ряд других механизмов. Медленно делящиеся клетки более устойчивы к токсинам, обычно присутствующим в больших количествах во время стационарной фазы. Но самое главное это то, что по достижении стационарной фазы происходит массовый автолиз клеток, и численность колонии уменьшается в 100-100000 раз. Такое уменьшение численности предположительно необходимо для снижения вероятности появления мутантов.
По данным анализа полностью и частично расшифрованных геномов, у прокариот идентифицированы белки, соответствующие апоптозным факторам млекопитающих (Самуилов и др., 2000). У бактерий обнаружены лиганд LRR, адаптерный домен TIR, АТРазный домен фактора APAF-1, гомолог каспазы. Эти микробные домены, по-видимому, вовлечены в различные регуляторные механизмы. Что ожидать от прокариот, если у них экспрессировать белки, замешанные в механизме ПГК у млекопитающих? Такие опыты проведены на Escherichia coli: клетки бактерии погибают при экспрессии внутриклеточной части рецептора Fas Т-лимфоцитов человека.
Прокариотическим аналогом апоптоза можно считать гибель части клеточной популяции Е. coli и ряда других бактерий в условиях стазиса - остановки роста бактериальной популяции (при исчерпании питательного субстрата, под влиянием того или иного стрессорного фактора). Так, голодающая популяция Е. coli разделяется на две субпопуляции, одна из которых гибнет и подвергается автолизу, в то время как другая субпопуляция использует продукты автолиза как питательный субстрат и продолжает расти, синтезировать РНК (судя по включению 3Н-уридиновой метки) и формировать колониеобразующие единицы.
Раскрыт генетический механизм ПГК в подобных прокариотических системах. Геном Е. coli содержит оперон с двумя генами: mazE и mazF (рис.10). Ген mazF кодирует стабильный цитотоксический белок, а mazE – нестабильное противоядие к белку MazF, быстро разрушаемое протеазой. В условиях голодания, когда происходит исчерпание фонда свободных аминокислот, активируется оперон rel, чей белковый продукт RelA отвечает за синтез гуанозинтетрафосфата. Гуанозинтетрафосфат блокирует экспрессию обоих генов: противоядие разрушается, и в результате стабильный белок-яд MazF вызывает гибель и автолиз части популяции, тем самым пополняя фонд аминокислот и вновь активируя синтез противоядия MazF у оставшихся в живых клеток Е. соli. Система mazE-mazF, расположенная на хромосоме Е. coli, аналогична многочисленным плазмидным
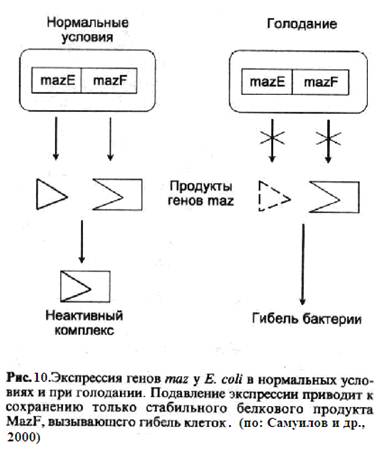
системам, которые кодируют стабильный цитотоксический агент в комбинации с лабильным противоядием к нему (такие плазмидные системы именуются модулями зависимости, addiction modules). Так, у Е. coli обнаружена плазмида, содержащая ген стабильной ДНК-рестриктазы и нестабильной ДНК-метилазы, которая предохраняет ДНК от рестриктазы (метилированная ДНК не может быть узнана рестриктазой). Утрата плазмиды влечет за собой прекращение синтеза метилазы, и стабильная рестриктаза фрагментирует вновь синтезируемую неметилированную ДНК и вызывает гибель потерявших плазмиду клеток. Поэтому подобные модули зависимости рассматривают как «эгоистичные ДНК»: гибнут те клетки, которые пытаются избавиться от этой ДНК; сохраняются те, которые распространяют ее. Участки hok/sok и pnd плазмид R1 и R483 кодируют токсины, вызывающие диссипацию мембранного потенциала и наряду с этим гены, транскрипция которых дает лабильные антисмысловые РНК, препятствующие транскрипции плазмидной ДНК, Плазмида F у Е. coli несет гены, отвечающие за синтез 1) токсина CcdB, который превращает ДНК-гиразу в ДНК-повреждающий агент и 2) белка-антидота CcdA, образующего с CcdB неактивный комплекс.
Приведенные примеры относятся к внутриклеточным механизмам ПГК, элиминирующим клетку, утратившую плазмиду с модулем зависимости. Имеются и внеклеточные механизмы ПГК: содержащие плазмиду клетки убивают соседей, не имеющих этой плазмиды. Речь идет о бактерицинах и подобных им агентах, чьи гены расположены на плазмидах вместе с генами, определяющими устойчивость к токсину самой бактериоцин-продуцирующей клетки. Внеклеточные токсины используют те же механизмы элиминирования чувствительных клеток, что и рассмотренные выше внутриклеточные токсины. Так, колицин Е1 и сходные с ним агенты, подобно плазмидам R1 и R483, ведут к деэнергизации цитоплазматической мембраны Е. coli, а микроцин В17 (как и белок CcdB, кодируемый плазмидой F) трансформирует ДНК-гиразу в ДНК-повреждающий агент. Известны также колицины (Е9), разрушающие ДНК; расщепляющие рибосомальную РНК и поэтому препятствующие синтезу белка; ингибирующие синтез пептидогликана клеточной стенки. Колициногенные клетки Е. coli защищаются от действия колицинов путем их комплексирования с белковым фактором иммунитета Im9 (молекулярная масса 9,5 кДа). Фактор Im9 соэкспрессируется с колицином и с высоким сродством связывается с колицином.
ПГК у бактерий наблюдается при заражении фагом. В этом плане в наибольшей мере исследована система Е. coli - Т-четные фаги. Подобно эукариотическим инфицированным клеткам, гибнущим, чтобы локализовать опасный для всего многоклеточного организма патоген, некоторые штаммы Е. coli несут гены, вызывающие гибель клетки после внедрения фага Т4. Так, ген lit блокирует синтез всех клеточных белков в ответ на экспрессию генов фага Т4. Ген lit кодирует протеазу, расщепляющую фактор элонгации EF-Tu, необходимый для синтеза белка на рибосомах. Ген рrrС кодирует нуклеазу, расщепляющую лизиновую тРНК. Нуклеаза активируется посредством пептидного продукта гена stp фага Т4. Гены тех вызывают у клеток, инфицированных фагом Т4, формирование трансмембранных ионных каналов, обрекающих эти клетки на гибель, если только фаг не закрывает каналы своими белками, продуктами генов rII. Гены, отвечающие за гибель клетки в ответ на внедрение вирулентного фага, локализуются в плазмидах или в геноме фагов (экспрессируясь в лизогенных клетках). Поэтому представляется вероятным, что «альтруистические» гены, будучи подвижными, легко утрачиваются, функционируя лишь у части бактериальной популяции.
ПГК представляет собой нормальную составную часть процесса развития многих прокариот. Агрегация клеток миксобактерий с формированием плодового тела со спорами сопряжена с гибелью значительной части клеточной популяции. При спорообразовании у бацилл отмирает вегетативная клетка, внутри которой созревает спора.
 2013-12-31
2013-12-31 806
806








