Основные этапы ферментативного катализа
Ферментативная реакция протекает через ряд промежуточных стадий. Различают 3 основных этапа ферментативного катализа:
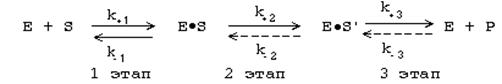
где S – субстрат, Е – фермент, Р – продукт.
1 этап. ОРИЕНТИРОВАННАЯ СОРБЦИЯ СУБСТРАТА НА АКТИВНОМ ЦЕНТРЕ С ОБРАЗОВАНИЕМ ОБРАТИМОГО ФЕРМЕНТ-СУБСТРАТНОГО КОМП-ЛЕКСА. На этом этапе происходит взаимодействие СЦ фермента с молекулой S, при этом S подвергается конформационной перестройке. Сорбция происходит за счет слабых типов связей между S и СЦ. В результате молекула S подается на каталитический центр в наиболее удобном для него положении. Первый этап является легко обратимым, потому что здесь участвуют только слабые типы связей. Кинетическая характеристика 1-го этапа ферментативного катализа - константа Михаэлиса (Км).
2 этап. ХИМИЧЕСКИЕ ПРЕВРАЩЕНИЯ МОЛЕКУЛЫ СУБСТРАТА В СОСТАВЕ ФЕРМЕНТ-СУБСТРАТНОГО КОМПЛЕКСА. ОБРАЗОВАНИЕ КОМПЛЕКСА ФЕРМЕНТА С ХИМИЧЕСКИ ПРЕОБРАЗОВАННЫМ СУБСТРАТОМ. На этом этапе разрываются одни ковалентные связи и возникают новые. Поэтому этот этап протекает медленнее, чем 1-й и 3-й этапы. Именно скорость второго этапа определяет скорость всей ферментативной реакции в целом.
 3 этап. ДЕСОРБЦИЯ ГОТОВОГО ПРОДУКТА ИЗ ЕГО КОМПЛЕКСА С ФЕРМЕНТОМ. Этот этап протекает легче, чем 2-й. Он, как и 2-й этап, тоже необратим. Исключение - обратимые ферментативные реакции.
3 этап. ДЕСОРБЦИЯ ГОТОВОГО ПРОДУКТА ИЗ ЕГО КОМПЛЕКСА С ФЕРМЕНТОМ. Этот этап протекает легче, чем 2-й. Он, как и 2-й этап, тоже необратим. Исключение - обратимые ферментативные реакции.
Для ферментов характерны все свойства белков + специфические функции:
- зависимость активности Ф от температуры. Температура, при которой каталитическая активность фермента максимальна – температурный оптимум фермента. Для Ф животного происхождения – 40-50 оС. При высоких значениях происходит денатурация белковой молекулы;
- зависимость активности Ф от рН среды. У большинства Ф максимальная активность при нейтральном значении рН. Пепсин желудка – рН 1.5-2.5. Ферменты кишечника – рН более 7. Изменение рН среды может привести к изменению третичной структуры Ф. (скажется на его активности) и изменению свойств субстрата (скажется на формировании фермент-субстратного комплекса);
- специфичность действия ферментов. Одно из основных свойств ферментов. Это избирательность Ф по отношению к одному субстрату или группе субстратов. По теории Э.Фишера (1894) специфичность объяснялась тем, что субстрат точно соответствует структуре субстратного центра как ключ и замок, т.е. активный центр фермента – это слепок субстрата. Однако эта гипотеза не смогла объяснить факт групповой специфичности, когда один Ф катализирует превращение нескольких субстратов. В 50-е гг. 20 века Д. Кошланд предложил теорию «вынужденного соответствия»: молекула Ф не жесткая, а гибкая и эластичная. Конформация субстратного центра изменяется при присоединении субстрата или других веществ. В момент присоединения субстрат «вынуждает» субстратный центр принять нужную форму – как перчатка и рука.
Различают 3 типа субстратной специфичности:
- стереохимическая субстратная специфичность - способность фермента катализировать превращения определенных стереоизомеров. Например, фермент оксидаза L-аминокислот способен окислять все аминокислоты, относящиеся к L-ряду;
- а бсолютная субстратная специфичность - способность фермента катализировать превращение только одного, строго определенного субстрата. Например: уреаза гидролизует только мочевину; г рупповая субстратная специфичность - способность фермента катализировать превращения группы субстратов, сходной химической структуры. Например, алькогольдегидрогеназа катализирует превращение этанола и других алифатических спиртов, но с разной скоростью.
Специфичность действия - это способность фермента катализировать только определенный тип химической реакции. В соответствии со специфичностью действия все ферменты делятся на 6 классов.
 2013-12-31
2013-12-31 1438
1438








