Теплоёмкостью какого-либо тела называется величина равная количеству тепла, необходимого для того, чтобы изменить температуру тела на 1 градус. Cтела=dQ/dT (Джоуль/К). Теплоёмкость моля вещества называется молярной теплоёмкостью C (Джоуль/(Моль× К)).
Удельной теплоемкостью вещества называется физическая величина, численно равная количеству энергии в форме теплоты, которое надо сообщить единице массы этого вещества для увеличения его температуры на 1 Кельвин (т.е. это теплоёмкость, отнесённая к единице массы вещества):
 , Дж/(кг×К)
, Дж/(кг×К)
Количество теплоты, поглощённой телом при изменении его состояния, зависит не только от начального и конечного состояний (в частности, от их температуры), но и от способа, которым был осуществлен процесс перехода между ними.
Молярная теплоемкость Сμв отличие от удельной теплоемкости, отнесена не к единице массы (1 килограмму), а к массе одного моля вещества. Очевидно, что
Cμ = m c, Дж/(моль×К)
|
где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT. Отсюда следует:

|
Отношение ΔV / ΔT может быть найдено из уравнения состояния идеального газа, записанного для 1 моля:
| pV = RT, |
где R – универсальная газовая постоянная. При p = const
 или или 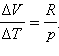
|
Таким образом, соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера):
| Cp = Cv + R. |

16. Изопроцессы идеального газа. Зависимость теплоемкости от вида процесса. Адиабатический процесс.
Изотермический процесс ( T = const )
Изотермическим процессом называют квазистатический процесс, протекающий при постоянной температуре T. Из уравнения (*) состояния идеального газа следует, что при постоянной температуре T и неизменном количестве вещества ν в сосуде произведение давления p газа на его объем V должно оставаться постоянным:
Q=A
Изохорный процесс ( V = const )
Изохорный процесс – это процесс квазистатического нагревания или охлаждения газа при постоянном объеме V и при условии, что количество вещества ν в сосуде остается неизменным.
Q=dU
Изобарный процесс ( p = const )
Изобарным процессом называют квазистатический процесс, протекающий при неизменным давлении p
Q=dU+A
адиаба́тныйпроце́сс — термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой с окружающим пространством.
dU=-A
17. Тепловые двигатели и холодильные машины. КПД. Обратимые и необратимые процессы. Круговой процесс. Цикл Карно для идеального газа и его КПД.
Тепловой двигатель - это периодически действующий двигатель, совершающий работу за счет полученной извне теплоты.
Термостатом называется термодинамическая система, которая может обмениваться теплотой с телами практически без изменения собственной температуры.
Рабочее тело - это тело, совершающее круговой процесс и обменивающееся энергией с другими телами.
В холодильной машине используется процесс, обратный тому, что происходит в тепловом двигателе (используется обратный цикл). За цикл системой от термостата с более низкой температурой T2 вычитается количество теплоты Q2 и отдается термостату с высокой температурой T1 количество теплоты Q1.
Коэффицие́нтполе́зногоде́йствия (КПД) — характеристика эффективности системы (устройства, машины) в отношении преобразования или передачи энергии. Определяется отношением полезно использованной энергии к суммарному количеству энергии, полученному системой;
Обратимым термодинамическим процессом называется термодинамический процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения.
Необходимым и достаточным условием обратимости термодинамического процесса является его равновесность.
2. Необратимым термодинамическим процессом называется термодинамический процесс, не допускающий возможности возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения
Круговой процесс (цикл) в термодинамике, процесс, при котором физическая система (например, пар), претерпев ряд изменений, возвращается в исходное состояние. Отношение А / Qn (совершённой системой работы к количеству полученной ею теплоты) называется коэффициентом полезного действия (кпд)
Цикл Карно: В термодинамике цикл Карно́ или процесс Карно — это обратимый круговой процесс, состоящий из двух адиабатических и двух изотермических процессов[1]. В процессе Карно термодинамическая система выполняет механическую работу и обменивается теплотой с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Резервуар с более высокой температурой называется нагревателем, а с более низкой температурой — холодильником
Таким образом, КПД цикла Карно, произведенного с идеальным газом, определяется только температурами T1 (горячего) и T2 (холодного) источников тепла: 
18. Второе начало термодинамики. Вечный двигатель второго рода. Статистическое толкование второго начала термодинамики. Энтропия в термодинамике. Изменение энтропии при изопроцессах. Статистическое толкование энтропии.
Второе начало термодинамики (второй закон термодинамики) устанавливает существование энтропии[1] как функции состояния термодинамической системы и вводит понятие абсолютной термодинамической температуры[2], то есть «второе начало представляет собой закон об энтропии»
Вечный двигатель второго рода — машина, которая, будучи пущена в ход, превращала бы в работу всё тепло, извлекаемое из окружающих тел. Невозможность осуществления вечного двигателя второго рода постулируется в термодинамике в качестве одной из эквивалентных формулировок второго начала термодинамики.
Статистический смысл понятия энтропии состоит в том, что увеличение энтропии изолированной системы связано с переходом этой системы из менее вероятного состояния в более вероятное.
Утверждение второго закона (начала) термодинамики о невозможности убывания энтропии в изолированной системе может быть истолковано статически, на основе молекулярно-кинетической теории строения вещества, с помощью формулы Больцмана:
S=kLnP+const
, где S - энтропия системы, k - постоянная Больцмана, P- термодинамическая вероятность состояния.
Энтропи́я- функция состояния термодинамической системы, определяющая меру необратимого рассеивания энергии. В статистической физике энтропия характеризует вероятностьосуществления какого-либо макроскопического состояния.
19. Закон Максвелла для распределения молекул идеального газа по скоростям теплового движения. Вероятностное толкование закона распределения Максвелла.
Закон распределения молекул идеального газа по скоростям, теоретически полученный Максвеллом в 1860 г. определяет, какое число dN молекул однородного (p = const) одноатомного идеального газа из общего числа N его молекул в единице объёма имеет при данной температуре Т скорости, заключенные в интервале от v до v + dv.
Для вывода функции распределения молекул по скоростям f(v) равной отношению числа молекул dN, скорости которых лежат в интервале v ÷ v + dv к общему числу молекул N и величине интервала dv

Максвелл использовал два предложения:
а) все направления в пространстве равноправны и поэтому любое направление движения частицы, т.е. любое направление скорости одинаково вероятно. Это свойство иногда называют свойством изотропности функции распределения.
б) движение по трем взаимно перпендикулярным осям независимы т.е. х-компоненты скорости  не зависит от того каково значения ее компонент
не зависит от того каково значения ее компонент  или
или  . И тогда вывод f (v) делается сначала для одной компоненты
. И тогда вывод f (v) делается сначала для одной компоненты  , а затем обобщается на все координаты скорости.
, а затем обобщается на все координаты скорости.
Распределение Максвелла — распределение вероятности, встречающееся в физике и химии. Оно лежит в основании кинетической теории газов, которая объясняет многие фундаментальные свойства газов, включая давление и диффузию
20. Барометрическая формула. Закон Больцмана для распределения частиц идеального газа во внешнем потенциальном поле
//////////////////////////////////////////////////////////////////////////////


//////////////////////////////////////////////////////////////////////////////
21. Среднее число столкновений и средняя длина свободного пробега молекул идеального газа. Эффективный диаметр молекулы.
Средняя длина свободного пробега — это расстояние,проходимое молекулой в среднем без столкновений. Средняя длина свободного пробега равно:
где – средняя скорость теплового движения, τ – среднее время между двумя столкновениями
За одну секунду молекула проходит путь, равный средней арифметической скорости. За ту же секунду молекула претерпевает ν столкновений. Следовательно,
На самом деле, все молекулы движутся (и в сторону, и навстречу друг другу), поэтому число соударений определяется средней скоростью движения молекул относительно друг друга.
По закону сложения случайных величин
(3.2.1)
А так как средняя длина свободного пробега то получим:
(3.2.2)
Уравнение состояния идеального газа позволяет нам выразить n через давление P и термодинамическую температуру Т.
Так как, то есть то
(3.2.3)
Таким образом, при заданной температуре средняя длина свободного пробега обратно пропорциональна давлению Р:
Эффективный диаметр молекулы - минимальное расстояние, на которое сближаются центры двух молекул при столкновении.
При столкновении молекулы сближаются до некоторого наименьшего расстояния, которое условно считается суммой радиусов взаимодействующих молекул. Столкновение между одинаковыми молекулами может произойти только в том случае, если их центры сблизятся на расстояние, меньшее или равное диаметру d — эффективному диаметру молекулы.
22. Явления переноса. Теплопроводность, диффузия, вязкость.
Явление переноса — особые необратимые процессы,возникающие в неравновесных системах. В результате эти процессов происходит пространственный перенос массы,энергии,импульса.
Распространение молекул примеси в газе от источника называется диффузией.
В состоянии равновесия температура Т и концентрация n во всех точках системы одинакова. При отклонении плотности от равновесного значения в некоторой части системы возникает движение компонент вещества в направлениях, приводящих к выравниванию концентрации по всему объему системы. Связанный с этим движением перенос вещества обусловлен диффузией. Диффузионный поток будет пропорционален градиенту концентрации:
Если какое-либо тело движется в газе, то оно сталкивается с молекулами газа и сообщает им импульс. С другой стороны, тело тоже будет испытывать соударения со стороны молекул, и получать собственный импульс, но направленный в противоположную сторону. Газ ускоряется, тело тормозится, то есть на тело действуют силы трения. Такая же сила трения будет действовать и между двумя соседними слоями газа, движущимися с разными скоростями. Это явление носит название внутреннее трение или вязкость газа, причём сила трения пропорциональна градиенту скорости:
Если в соседних слоях газа создана и поддерживается разность температур, то между ними будет происходить обмен тепла. Благодаря хаотическому движению, молекулы в соседних слоях будут перемешиваться и их средние энергии будут выравниваться. Происходит перенос энергии от более нагретых слоев к более холодным телам. Этот процесс называется теплопроводностью. Поток тепла пропорционален градиенту температуры:
В состоянии равновесия в среде, содержащей заряженные частицы, потенциал электрического поля в каждой точке соответствует минимуму энергии системы. При наложении внешнего электрического поля возникает неравновесное движение электрических зарядов в таком направлении, чтобы минимизировать энергию системы в новых условиях. Связанный с этим движением перенос электрического заряда называется электропроводностью, а само направленное движение зарядов - электрическим током.
23. Реальные газы. Силы и потенциальная энергия межмолекулярного взаимодействия. Уравнение Ван-дер-Ваальса. Изотермы реального газа. Критическое состояние. (Внутренняя энергия реального газа.)
///////////////////////////////////////////


//////////////////////////////////////////////////////////////////
 2018-03-09
2018-03-09 1043
1043







