Второй закон Рауля определяет зависимость температуры кристаллизации и кипения раствора от концентрации растворенного вещества: Повышение температуры кипения и понижение температуры кристаллизации разбавленных идеальных растворов пропорциональны моляльной концентрации растворенного вещества. Δtкип = Ккип·Сm, Δtкp = Ккр·Сm.
Здесь Сm -моляльная концентрация раствора (моль/кг); Ккип - эбуллиоскопическая константа или константа кипения растворителя; Ккр - криоскопическая константа или константа кристаллизации растворителя.
Температура кипения и замерзания растворов. Приведение основных формул для расчёта молярной массы.
Температура кипения жидкости – это температура, при которой давление насыщенного пара над жидкостью равно внешнему давлению. M2 = E ∙ 1000∙g2 / ΔТкип ∙g1
Любое чистое вещество, находящееся в жидком состоянии, характеризуется определённой температурой замерзания, при которой оно полностью отвердевает.M2 = Kзам ∙ 1000∙g2 / ΔТзам ∙g1
5.Осмос. Осмотическое давление. Закон Вант-Гоффа(формулировка и математические выражения) для электролитов и неэлектролитов. Экзоосмос и эндоосмос.
Осмос- процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону большей концентрации растворённого вещества из объёма с меньшей концентрацией растворенного вещества.
Осматическое давление-сила,заставляющая растворитель переходить через тонкую полупроницаемую перегородку в раствор.
Закон Вант-Гоффа: Осматическое давление разбавленного раствора неэлектролита равно тому давлению, которое производило бы растворенное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объем, равный объему раствора.Величину осмотического давления можно вычислять по следующей формуле: πосм = СRT, где С – концентрация вещества в растворе, R – универсальная газовая постоянная, Т – абсолютная температура.
Для растворов электролитов формулу Вант-Гоффа записывают так: πосм= iCRT.
Эндосмос-явление движения растворителя из окружающей среды в осмотическую ячейку
Экзосмос-это движение растворителя из осмотической ячейки в окружающую среду.
Роль осмоса и осмотического давления в биологических системах. Тургор,лизис, плазмолиз, гемолиз. Изотанические, гипотонические и гипертоноческие растворы.
Явление осмоса играет важную роль во многих химических системах. Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. Упругость клеток (тургор), обеспечивающая эластичность тканей и сохранение определенной формы органов, обусловлена осмотическим давлением.
Разрушение клеток путем разрыва их оболочек (или поверхностных слоев протоплазмы) называют— гемолизом.
В крепких растворах солей отмечается сморщивание клеток -плазмолиз-, обусловленное потерей воды, перемещающейся из них в более концентрированный внешний раствор.
Растворы, имеющие одинаковое осмотическое давление, называются изотоническими. Если два раствора имеют различное осмотическое давление, то раствор с большим осмотическим давлением является гипертоническим по отношению ко второму.
Физико-химия поверхностных явлений и дисперсных систем в функционировании живых систем. Поверхностное явление. Адсорбция.
Природа поверхностной энергии.Поверхностноенатяжение.Физическийсмсл поверхностного натяжения.Энергетическое и силовое выражение поверхностного натяжения.Зависимость поверхностного натяжения от тимпературы.
Поверхностные явления - совокупность явлений, обусловленных особыми свойствами тонких слоёв вещества на границе соприкосновения фаз. К поверхностным явлениям относят те эффекты и особенности поведения веществ, которые наблюдаются на поверхностях раздела фаз.
Поверхностное натяжение – это характеристика поверхности раздела двух фаз, находящихся в равновесии. Поверхностное натяжение имеет место на границах твердое тело-жидкость, жидкость-газ, жидкость-жидкость, твердое тело-газ .Физическая сущность – поверхностные молекулы стремятся уйти вглубь конденсированной фазы, тем самым, сжимая поверхность.
Энергетическому и силовому определению поверхностного натяжения соответствует энергетическая и силовая единица измерения. Энергетической единицей является Дж/м2, силовой – Н/м. Энергетическое и силовое выражение эквивалентны, и численная величина совпадает в обеих размерностях. Так для воды при 293 К:
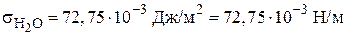 .
.
Одна размерность легко выводится из другой: СИ: Дж/м2 = Н∙м/м2 =Н/м.
С увеличением температуры величина поверхностного натяжения уменьшается и равна нулю при критической температуре. Наиболее известная эмпирическая зависимость поверхностного натяжения от температуры была предложена ЛорандомЭтвёшом, так называемое правило Этвёша (англ.). В настоящее время получен вывод теоретической зависимости поверхностного натяжения от температуры в области до критических температур, подтверждающей правило Этвёша.
2. 5.поверхностная активность (g) как характеристика поведения вещества при адсорбции.
g = - (dσ/dc) c → 0 Чем в большей степени уменьшается поверхностное натяжение с увеличением концентрации адсорбируемого вещества, тем больше поверхностная активность этого вещества, и тем больше его гиббсовая адсорбция.
3. Методы определения поверхностного натяжения.
Методы поверхностного натяжения: Для границы «жидкая фаза – воздух» можно пренебречь межмолекулярным взаимодействием в воздухе (Fгаз-газ = 0), поэтому поверхностное натяжение характеризует интенсивность межмолекулярных взаимодействий в конденсированной фазе. Поверхностного натяжение на границе «жидкость – жидкость» зависят от природы соприкасающихся фаз: чем больше разница полярности фаз, тем больше поверхностного натяжения на границе их раздела. Поверхностного натяжение на границе «жидкость – газ» яв-ся мерой гетерогенной системы. При повышении давления увеличивается взаимодействие поверхностных молекул жидкости с молекулами газовой фазы и уменьшается избыток энергии молекул на поверхности, а также уменьшается поверхностное натяжение.
4. Зависимость поверхностного натяжения от природы и концентрации растворенного вещества(ПАВ,ПИВ и ПНВ).Ориентация молекул ПАВ в поверхностном слое. Правило Дюкло-Траубле.
1. Если Г › 0, т.е. концентрация растворенного вещества в поверхностном слое больше, чем в объёме раствора, то dσ/dc‹ 0. Это характерно для веществ, полярность которых меньше полярности растворителя. Вещества менее полярные, чем растворитель, накапливаются в поверхностном слое и понижают поверхностное натяжение. Эти вещества адсорбируются положительно.Их называют (ПАВ). Важнейшие ПАВ – водоростворимые органические соединения, молекулы которых состоят из двух частей: полярной (гидрофильной) и неполярной (гидрофобной). Если в данном растворителе полярная часть диссоциирует, то ПАВ называется ионогенным (это мыла, моющие вещества), в противном случае – неионогенным (жирные спирты).
2. При добавлении веществ более полярных, чем растворитель, поверхностное натяжение увеличивается Г ‹ 0. В этом случае концентрация более полярного вещества в поверхностном слое меньше, чем в объеме раствора. Их называют (ПИВ). К ним относятся сильные электролиты: кислоты, соли, щелочи. Ионы этих соединений взаимодействуют сильнее с молекулами воды, чем молекулы воды друг с другом. Поэтому значительная часть ионов увлекается внутрь объема раствора. Оставшиеся на поверхности ионы создают силовое поле, тем самым повышая поверхностное натяжение.
3. Есть вещества, которые не изменяют поверхностное натяжение Г=0.Их называют (ПНВ). К таким веществам относятся соединения, имеющие много функциональных групп (сахароза С12Н22О11).
Ориентация молекул ПАВ в поверхностном слое (независимого поверхностного действия) принцип независимости поверхностного действия, заключающийся в том, что при адсорбции полярная группа, обладающая большим сродством к полярной фазе, втягивается в воду, в то время как неполярный радикал выталкивается в неполярную фазу. Происходящее при этом уменьшение свободной поверхностной энергии ограничивает размеры поверностного слоя толщиной в одну молекулу. Образуется мономолекулярный слой: а) малые концентрации ПАВ. При малых концентрациях ПАВ, углеводородные радикалы (R), вытолкнутые в воздух, «плавают» на поверхности воды, затем, по мере роста концентрации ПАВ, они начинают подниматься. б) умеренные концентрации в) насыщенный адсорбционный слой. В насыщенном адсорбционном слое поверхность воды оказывается сплошь покрытой «частоколом Ленгмюра» из вертикально ориентированных молекул ПАВ. Значение поверхностного натяжения в этом случае приближается к значению, характерному для чистого жидкого ПАВ на границе с воздухом
- Правило Дюкло-Траубе —поверхностная активность ПАВ одного и того же гомологического ряда в водном растворе возрастает в среднем в 3,2 раза при увеличении цепи на одну группу -СН2-.
 2018-03-09
2018-03-09 171
171








