Внести в пробирку 5-6 капель раствора соли хрома (III) и приливать к нему по каплям раствор щелочи до появления осадка. Отметить его цвет. Составить уравнение реакции.
Содержимое пробирки разделить на две части. К одной части прилить раствор серной кислоты, к другой – раствор щелочи. Сравнить цвет полученных растворов. Составить уравнения реакций.
В пробирку, содержащую раствор гексагидроксохромата (III)-иона, прилить раствор кислоты до образования осадка Cr(OH)3. Составить уравнение реакции. Сделать вывод о характере гидроксида хрома (III).
Опыт 2. Восстановительные свойства соединений хрома (III)
Внести в пробирку 1-2 капли раствора соли хрома (III) и добавить щелочи до растворения образующегося вначале осадка гидроксида хрома. Полученный раствор, содержащий гексагидроксохромат (III)-ион, разлить в три пробирки. В одну из них добавить хлорной воды, во вторую – бромной воды, в третью – раствор пероксида водорода Н2О2. Нагреть пробирки, отметить изменение цвета растворов. Написать уравнения реакций окисления хрома (III) в хрома (VI) в присутствии щелочи:
[Cr(OH)6]3- + 2OH- - 3e- ↔ CrO 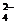 + 4H2O.
+ 4H2O.
Опыт 3. Окислительные свойства соединений хрома (III)
К раствору соли хрома (III) добавить соляной кислоты и разделить содержимое на две пробирки. Одну пробирку оставить для контроля, в другую поместить 2-3 кусочка цинка, прилить немного бензола и закрыть ее пробкой с трубкой, конец которой опустить в воду. Через несколько минут наблюдать изменение цвета раствора. Указать, зачем наливается слой бензола и отводная трубка опускается в воду. Написать уравнение реакции.
Опыт 4. Окислительные свойства соединений хрома (VI)
1) Внести в две пробирки по 4-5 капель раствора дихромата калия, подкислить его раствором серной кислоты и добавить в первую пробирку сероводородной воды, во вторую – по каплям раствор сульфита натрия. Составить уравнения реакций.
2) Внести в пробирку 4-5 капель раствора дихромата калия, подкислить его раствором серной кислоты и поместить туда же кристалл соли железа (II). Наблюдать изменение окраски раствора. Составить уравнение реакции.
Опыт 5. Хроматы и дихроматы
1) В пробирку с 3-4 каплями раствора хромата калия добавить столько же раствора серной кислоты. Отметить изменение цвета раствора. Написать уравнение реакции в ионной форме.
2) В пробирку с 3-4 каплями раствора дихромата калия добавить несколько капель раствора щелочи. Отметить изменение окраски раствора. Написать уравнение реакции в ионной форме.
Опыт 6. Получение молибденовой кислоты и изучение ее свойств
В пробирку внести 3-4 капли насыщенного раствора молибдата аммония (NH4)2MoO4 и осторожно по каплям добавлять концентрированный раствор серной кислоты до выпадения белого осадка. Испытать его отношение к раствору гидроксида натрия и к концентрированной серной кислоте. Написать уравнения реакций.
Опыт 7. Образование «молибденовой сини»
В пробирку внести 3-4 капли раствора молибдата аммония. Добавить 2-3 капли раствора соляной кислоты и по каплям раствор хлорида олова (II) до появления синей окраски смеси от Мо2О5 до МоО3.
Опыт 8. Получение вольфрамовой кислоты и изучение ее свойств
В пробирку налить 3-4 капли насыщенного раствора вольфрамата натрия Na2WO4 и осторожно добавить 3 капли концентрированного раствора серной кислоты. Пробирку слегка нагреть. Отметить цвет полученного осадка WO3·nH2O. Испытать его отношение к раствору гидроксида натрия и к концентрированной серной кислоте. Составить уравнения реакций.
Опыт 9. Получение «вольфрамовой сини»
В сухую пробирку внести несколько кристаллов вольфрамата аммония (NН4)2WO4 и 2-3 кристалла хлорида олова (II), добавить несколько капель концентрированной соляной кислоты до появления интенсивно-синего окрашивания «вольфрамовой сини» сложного состава от WO2 до WO3.
Контрольные вопросы:
1. Дихроматы устойчивы в кислой среде, хроматы – в щелочной. При изменении реакции среды происходит взаимное превращение хроматов и дихроматов. Составить в ионной форме уравнения реакций взаимодействия: дихромата калия и гидроксида калия; хромата калия и серной кислоты.
2. Составить уравнение реакции разложения при нагревании дихромата аммония. К какому типу реакций относится этот процесс?
3. Как изменяется устойчивость соединений хрома, молибдена и вольфрама в высшей степени окисления? Привести примеры окислительно-восстановительных реакций, в которые вступают эти соединения.
Какой продукт получается при подкислении раствора молибдата аммония?
 2018-03-09
2018-03-09 556
556








