D-элементы VII группы (Mn, Tc, Re)
Опыт 1. Взаимодействие марганца с кислотами
Испытать действие на марганец разбавленных и концентрированных растворов кислот: соляной, серной, азотной. Для этого взять шесть пробирок, поместить в каждую металлический марганец, добавить соответствующие кислоты различной концентрации. Записать наблюдения. Написать уравнения реакций. Сделать вывод об отношении марганца к кислотам.
Опыт 2. Качественные реакции на ионы Mn2+
1) В пробирку с раствором соли марганца (II) добавить раствор сульфида аммония. Отметить цвет осадка. Написать уравнение реакции.
2) В пробирку поместить немного порошка оксида свинца (IV), добавить 5-6 капель концентрированной азотной кислоты, несколько капель раствора соли марганца (II). Содержимое пробирки нагреть до кипения, затем остудить. Отметить окраску раствора, характерную для ионов MnO 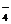 . Составить уравнение реакции.
. Составить уравнение реакции.
Опыт 3. Получение и свойства гидроксида марганца (II)
Внести в пробирку раствор соли марганца и добавить раствор гидроксида натрия. Отметить цвет осадка. Полученный осадок перенести в две пробирки. Исследовать отношение гидроксида марганца (II) к растворам соляной кислоты и гидроксида натрия. Написать уравнения реакций.
Опыт 4. Окислительно-восстановительная двойственность оксида марганца (IV)
1) В пробирку поместить 2 микрошпателя оксида марганца (IV), прилить растворы серной кислоты и сульфата железа (II). Записать наблюдения и уравнение реакции. Какие окислительно-восстановительные свойства проявляет марганец (IV)?
2) Сплавить в небольшом тигле нитрат калия с гидроксидом калия. В расплав добавить несколько крупинок оксида марганца (IV). Записать наблюдения и уравнение реакции. Какие окислительно-восстановительные свойства проявляет марганец (IV)?
Опыт 5. Окислительные свойства марганца (VII) и влияние среды на силу окислителя
1) В пробирку с раствором перманганата калия прибавить раствор соли марганца (II). Отметить изменение окраски раствора и появление осадка. Написать уравнение реакции.
2) В пробирку внести раствор перманганата калия, прибавить 2 капли разбавленного раствора серной кислоты и раствор пероксида водорода до изменения окраски. Определить выделяющийся газ тлеющей лучиной. Написать уравнение реакции.
3) В три пробирки внести по несколько капель раствора перманганата калия. В первую пробирку добавить раствор разбавленной серной кислоты, во вторую – воду, в третью – раствор щелочи. Затем в каждую пробирку добавить раствор восстановителя (Na2SO3 или NaNO2). Написать уравнения реакций. Используя таблицу стандартных окислительно-восстановительных потенциалов, обосновать, в какой среде окислительные свойства перманганата проявляются более сильно.
Контрольные вопросы:
1. Написать электронные и электронно-графические формулы Mn0, Mn+4, Mn+7.
2. Привести уравнения реакций, показывающие отношение металлов VIIВ-группы к растворам серной и азотной кислот различной концентрации.
3. Используя таблицу стандартных окислительно-восстановительных потенциалов, доказать возможность протекания реакции между растворами KMnO4 и HCl. Определить окислитель, восстановитель, среду.
Сопоставить свойства оксидов и гидроксидов марганца (VII) и хлора (VII).
Лабораторная работа №12
D-элементы VIII группы (Fe, Co, Ni)
 2018-03-09
2018-03-09 210
210








