Ход работы. Для определения буферной емкости по кислоте в колбу емкостью 25 мл налить по 5 мл 0,2 М раствора СН3СООН и CH3COONa. В другой колбе приготовить контрольный раствор: смесь 1 мл 0,2 М CH3COONa и 9 мл 0,2 М СН3СООН. В обе колбы внести по 5 капель метилового оранжевого и рассчитать рН полученных растворов по уравнению Гендерсона – Гассельбаха. Исследуемую смесь оттитровать соляной кислотой до получения одинаковой окраски с контрольным раствором. Окраску сравнить на фоне белой бумаги. Буферную емкость Вк рассчитать по формуле:
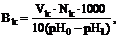
где Vk – объем НСl, мл;
Nk – нормальная концентрация эквивалента HCl, н.;
рН0 – водородный показатель исходного раствора;
pH1 – водородный показатель контрольного раствора
Занятие №7
Лабораторная работа
Получение КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
И их свойства
Реакции комплексообразования
В пробирку налить несколько капель раствора СuС12 и приливать по каплям раствор аммиака до образования осадка Сu(ОН)2, затем прилить избыток раствора аммиака до растворения осадка.
Сравнить окраску ионов Сu2+ с окраской полученного раствора. Написать уравнение реакции образования комплексного соединения, учитывая, что координационное число Сu2+ равно четырем. Какое основание является более сильным: гидроксид меди (II) или образовавшееся комплексное основание? Почему?
Сравнение простых ионов железа (III) с комплексными ионами
а) К нескольким каплям раствора FeCl3 прилить немного раствора KCSN. Написать уравнение реакции. Какой цвет раствора? Эта реакция является характерной реакцией на ионы Fe3+.
б) Проделать то же самое с раствором К3[Fe(CN)6].
Обнаруживаются ли ионы Fe3+ в растворе K3[Fe(CN)6]?
в) В одну пробирку налить немного раствора FeCl3, а в другую – K3[Fe(CH)6] и добавить в каждую из них по несколько капель раствора FeSO4. Объяснить отсутствие изменений в первой пробирке и образование осадка во второй. Реакция образования турнбулевой сини является характерной для иона Fe2+ и комплексного иона [Fe(CN)6]3-. Написать уравнение реакции образования турнбулевой сини KFe[Fe(CN)6] в молекулярной и ионной форме.
Влияние концентрации раствора на комплексообразование
К нескольким каплям раствора CoCl2 прилить концентрированный раствор KCSN. Наблюдать изменение цвета раствора вследствие образования комплексной соли К2 [Co(CSN)4] Разбавить полученный раствор водой.
Объяснить изменение его цвета, написать уравнения реакций. Какое влияние оказывает концентрация раствора на комплексообразование?
ЗАНЯТИЕ №8
ОКИСЛИТЕЛЬНО- ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА
 2018-03-09
2018-03-09 301
301








