Sp-гибридизация
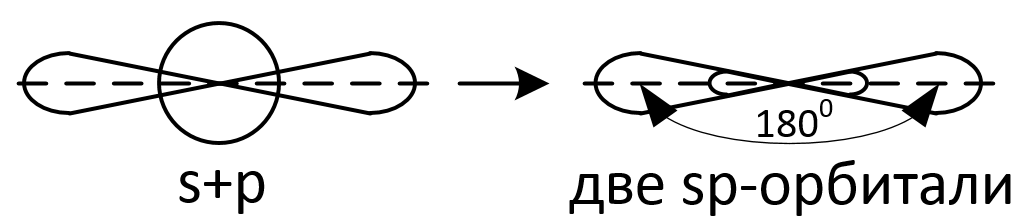
Из одной s -орбитали и одной р -орбитали образуются две гибридные, смешанные орбитали sp -типа, направленные по отношению друг к другу на 180°.
Например: линейную форму имеют молекулы ВеН2 и SnCl2 с sp -гибридизацией атома бериллия и олова соответсвенно.
sp2-гибридизация
Из одной s -орбитали и двух р -орбиталей образуются три sp2 -гибридные орбитали, расположенные в одной плоскости под углом 120° друг к другу.
Взаимная ориентация трех sp2 -гибридных орбиталей - тригональная. Концепцию sp2 -гибридизации применяют для описания плоских молекул тригональной формы.
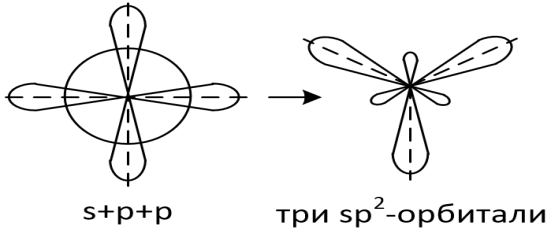
Например: молекула фторида алюминия A1F3. Возбуждение атома алюминия сопровождается распариванием s2 -электронов внешнего уровня на p -подуровень. Следовательно, электронная конфигурация внешнего уровня атома алюминия в возбужденном состоянии - 3s13p2. Заселенные электронами орбитали атома алюминия гибридизируются и ориентируются в одной плоскости под углом 120° друг к другу. Каждое из трех электронных облаков гибридных sp2 -орбиталей перекрывается с электронными облаками p -орбиталей трех атомов фтора.
sp3-гибридизация
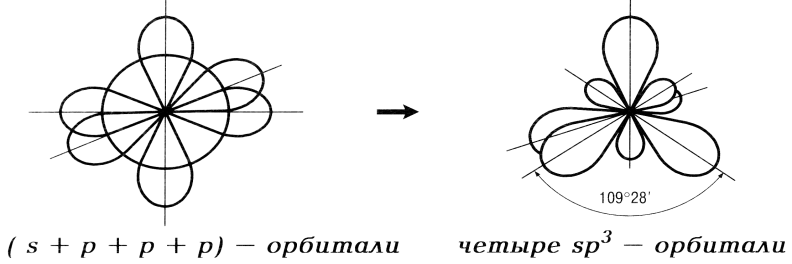
sp3 -гибридизация имеет место, если объединяются одна s -орбиталь и три р -орбитали; образуются четыре sp3 -гибридные орбитали, ориентированные уже не в одной плоскости, а в объеме тетраэдра и направленные от центра тетраэдра к его 4 вершинам; валентный угол между двумя химическими связями составляет 109°28'.
Например: строение молекулы метана СН4. Атом углерода в возбужденном состоянии имеет четыре неспаренных электрона: один s- и три р- электрона. Казалось бы, четыре химические связи, образованные ими с s- электронами четырех атомов водорода, должны быть неравноценными. Однако экспериментально установлено, что все 4 связи в молекуле СН4 совершенно идентичны по длине и энергии, а углы между связями составляют 109°28'. Следовательно, в молекуле СН4 имеет место sp3 -гибридизация.
Возможны более сложные случаи гибридизации с участием d -электронов, (например, sp3d2 - гибридизация).
Явление гибридизации, т.е. смешения, выравнивания электронной плотности, энергетически выгодно для атома, поскольку у гибридных орбиталей происходит более глубокое перекрывание и образуются более прочные химические связи. Небольшие затраты энергии на возбуждение атома и гибридизацию орбиталей с избытком компенсируются энергией, выделяющейся при возникновении химических связей. Валентные углы диктуются соображениями максимальной симметрии и устойчивости.
На гибридных орбиталях, как и на обычных орбиталях, может располагаться не только по одному электрону, но и по два. Например, четыре sp3 -гибридные орбитали атома кислорода О таковы, что две из них содержат по паре электронов, а две - одному неспаренному электрону. С современных позиций строение молекулы воды рассматривается с учетом гибридизации орбиталей атома О и тетраэдрической структуры молекулы Н2O в целом.
9. Сигма связь -это ковалентная связь, образующаяся перекрыванием электронных облаков «по осевой линии». Характеризуется осевой симметрией. Связь, образующаяся при перекрывании гибридных орбиталей вдоль линии, соединяющей ядра атомов.Рис.1.Сигма-связь

Пи-связь (π-связь) — ковалентная связь, образующаяся перекрыванием p-атомных орбиталей. В отличие от сигма-связи, осуществляемой перекрыванием s-атомных орбиталей вдоль линии соединения атомов, пи-связи, возникают при перекрывании p-атомных орбиталей по обе стороны от линии соединения атомов. Считается, что пи-связь реализуется в кратных связях — двойная связь состоит из одной сигма- и одной пи-связи, тройная — из одной сигма- и двух ортогональных пи-связейРис. 2.Пи-связь (π-связь)

10. Метод молекулярных орбиталей (МО) является наиболее универсальным широко применяемым методом описания природы химической связи. Этот метоп базируется на последних достижениях в области квантовой механики и требует привлечения сложного математического аппарата. В настоящем разделе рассматриваются основные качественные выводы о природе и свойствах химической связи. Основные положения метода молекулярныхорбиталей заключается в следующем:
1. Все электроны принадлежат молекуле в целом и перемещаются в поле ее ядер и электронов.
2. В пространстве между ядрами создается повышенная электронная плотность вследствие квантово-механического эффекта обменного взаимодействия всех обобществленных (делокализованных) электронов. Отметим, что в действительности основной вклад вносят делокализованные валентные электроны атомов.
3. Образование химической связи рассматривается, как переход электронов с атомных орбиталей на молекулярные обитали, охватывающие все ядра, с выигрышем энергии.Если переход на молекулярные орбитали связан с зажатой энергии, то молекула не образуется.
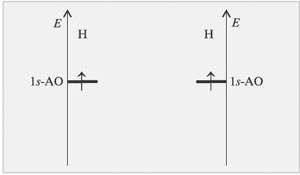
4. Решение задачи сводится к нахождению возможных МО, распределению на них электронов в соответствии с квантово-механическими принципами (принцип минимума, энергии, запрет Паули, правило Гунда) и заключению по свойствам образующейся (или нет) молекулярной системы.Молекулярныеорбитали получаются при комбинировании атомных орбиталей (АО) отсюда название методом МО ЛКАО (МО-линейная комбинация атомных орбиталей).Применим метод МО ЛКАО и разберем строение молекулы водорода. Изобразим на двух параллельных диаграммах энергетические уровни атомных орбиталей исходных атомов водорода (рис. 3.5).
11. Ионная связь – это связь между атомами резко отличающимися по электроотрицательности: у одного она очень высокая, у другого – низкая. В этом случае, атом с меньшейэлектроотрицательностью полностью отдает свои валентные электроны атому с большей электроотрицательностью. Ионная связь образуется между металлами и неметаллами.
Такой тип связи в NaCl, CsBr, NH4Cl и др. При образовании ионной связи образуются заряженные частицы: ионы.
Катионы – положительно заряженные ионы. Их образуют атомы, в которых мало валентных электронов и они слабо связаны с ядром. Это атомы щелочных и щелочноземельных металлов.
Анионы – отрицательно заряженные ионы. Их легче всего образуют галогены. Элементы главной подгруппы 7 группы. До завершения валентного уровня им не хватает всего одного электрона.
Схема образования ионной связи на примере хлорида натрия.

Атом натрия, имеет на внешнем уровне всего один электрон. Он легко отдает его, превращаясь в катион натрия Na+. Атому хлора до октета электронов не хватает одного электрона. Он его забирает у атома натрия, превращаясь в анион хлора Cl-.
- Ионная связь возникает за счет сил электростатического притяжения разноименно заряженных ионов.
12. Силы Ван-дер-Ваальса (Вандерваа́льсовыси́лы[1]) — силы межмолекулярного (и межатомного) взаимодействия с энергией10—20 кДж/моль. Этим термином первоначально обозначались все такие силы, в современной науке он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей. Открыты Й. Д. Ван дер Ваальсомв 1869 году.
Вандерваальсовы силы межатомного взаимодействия инертных газовобусловливают возможность существования агрегатных состоянийинертных газов (газ, жидкость и твёрдые тела). К вандерваальсовым силам относятся взаимодействия между диполями (постоянными и наведёнными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия, а также водородные связи, определяют формирование пространственной структуры биологических макромолекул. Вандерваальсовы силы также возникают между частицей (макроскопической частицей или наночастицей) и молекулой и между двумя частицами[2][3][4].Вандерваальсово взаимодействие состоит из трёх типов слабых электромагнитных взаимодействий: Ориентационные силы, диполь-дипольное притяжение. Осуществляется между молекулами, являющимися постоянными диполями. Примером может служить HCl в жидком и твёрдом состоянии. Энергия такого взаимодействия обратно пропорциональна кубу расстояния между диполями.Дисперсионное притяжение (лондоновские силы, дисперсионные силы). Обусловлены взаимодействием между мгновенным и наведённым диполем. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.Индукционное притяжение (поляризационное притяжение).Взаимодействие между постоянным диполем и наведённым (индуцированным). Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями. До сих пор многие авторы исходят из предположения, что вандерваальсовы силы определяют межслоевое взаимодействие в слоистых кристаллах, что противоречит экспериментальным данным: масштабу анизотропии температуры Дебая и, соответственно, масштабу анизотропии решёточного отражения. Исходя из данного ошибочного[5] предположения построены многие двумерные модели, «описывающие» свойства, в частности графита и нитрида бора. В последнем случае действуют так называемые силы Казимира и Казимира — Лифшица.
13. Структура комплексных соединений
Большинство комплексных соединений имеют внутреннюю и внешнюю сферы. Записывая химические формулы комплексных соединений, внутреннюю сферу заключают в квадратные скобки. Например, в комплексных соединениях К[Al(OH)4] и [Ca(NH3)8]Cl2, внутренней сферой являются группы атомов (комплексы) — [Al(OH)4]— и [Ca(NH3)8]2+, а внешней сферой — ионы К+ и Сl–соответственно.
Центральный атом или ион внутренней сферы называют комплексообразователем. Обычно, в качестве комплексообразователей выступают атомы или ионы металлов с достаточным количеством свободных орбиталей – это p-, d-, f- элементы: Cu2+, Pt2+, Pt4+, Ag+, Zn2+, Al3+и др. Но это может быть и атомы элементов, образующих неметаллы. Заряд комплексообразователя обычно положительный, но также может быть отрицательным или равным нулю и равен сумме зарядов всех остальных ионов. В приведенных выше примерах комплексообразователями являются ионы Al3+и Ca2+. Комплексообразователь окружен и связан сигма-связью с ионами противоположного знака или нейтральными молекулами, так называемыми лигандами. В качестве лигандов в комплексных соединениях могут выступать такие анионы, как F– , OH–, CN–, CNS–, NO2–, CO32–, C2O42–и др., или нейтральные молекулы Н2О, NН3, СО, NО и др. В наших примерах это – ионы OH— и молекулы NH3. Количество лигандов в различных комплексных соединениях лежит в пределах от 2 до 12. А само число лигандов (число сигма-связей) называется координационным числом (к.ч.) комплексообразователя. В рассматриваемых примерах к.ч. равно 4 и 8.
Заряд комплекса (внутренней сферы) определяется как сумма зарядов комплексообразователя и лигандов.
Внешнюю сферу образуют ионы, связанные с комплексом ионной или межмолекулярной связью и имеющие заряд, знак которого противоположен знаку заряда комплексообразователя. Числовое значение заряда внешней сферы совпадает с числовым значением заряда внутренней сферы. В формуле комплексного соединения записываются они за квадратными скобками. Внешняя сфера может и вовсе отсутствовать, в случае, если внутренняя сфера нейтральна. В приведенных примерах, внешнюю сферу образуют 1 ион K+ и 2 иона Cl— соответственно.
Классификация комплексных соединений
Основываясь на различных принципах, комплексные соединения можно классифицировать различными способами:
По электрическому заряду: катионные, анионные и нейтральные комплексы.
Катионные комплексы имеют положительный заряд и образуются если вокруг положительного иона координированы нейтральные молекулы. Например, [Al(H2O)6]Cl3, [Ca(NH3)8]Cl2
Анионные комплекс ы имеют отрицательный заряд и образуются, если вокруг положительного иона координированы атомы с отрицательной степенью окисления. Например, К[Al(OH)4], K2[BF4] Нейтральные комплексы имеют заряд равный нулю и не имеют внешней сферы. Они могут образоваться при координации вокруг атома молекул, а также при одновременной координации вокруг центрального положительно заряженного иона отрицательных ионов и молекул.По количеству комплексообразователей:
Одноядерные – комплекс содержит один центральный атом, например, K2[Be(SO4)2]
Многоядерны е — комплекс содержит два и более центральных атомов, например, [CrFe(NH3)6(CN)6]
По типу лиганда
Гидраты – содержат акво-комплексы, т.е. в качестве лигандов выступают молекулы воды. Например, [Cr(H2O)6]Br3, [Co(H2O)6]Br2
Аммиакаты – содержат аммин-комплексы, в которых в качестве лигандов выступают молекулы аммиака (NН3). Например, [Zn(NH3)4]Cl2, [Ag(NH3)2]Cl
Карбонилы – в таких комплексных соединениях, в качестве лигандов выступают молекулы монооксида углерода. Например, [Ni(CO)4],.
Ацидокомплексы – комплексные соединения, содержащие в качестве лигандов кислотные остатки как кислородсодержащих, так и бескислородных кислот (F–, Cl–, Br–, I–, CN–, NO2–, SO42–, PO43–и др., а также ОН–). Например, K4[Ni(CN)6], Na2[FeCl4]
Гидроксокомплексы — комплексные соединения, в которых в качестве лигандов выступают гидроксид-ионы: K2[Zn(OH)4], Cs2[Sn(OH)6]
Комплексные соединения могут содержать лиганды, относящиеся к различным классам приведенной классификации. Например: К[Pt(H2O)3Br3], [Cr(NH3)4Br2]Br
По химическим свойствам: кислоты, основания, соли, неэлектролиты:
Кислоты — H[AuBr4], H2[PtCl6]
Основания — [Cu(NH3)4](OH)2,[Ag(NH3)2]OH
Соли — Cs3[Al(OH)6], [Ni(H2O)4]Cl2
Неэлектролиты — [Pt(NH3)2Cl2]
По количеству мест, занимаемых лигандом в координационной сфере
В координационной сфере лиганды могут занимать одно или несколько мест, т.е. образовывать с центральным атомом одну или несколько связей. По этому признаку различают:
Монодентатныелиганды – это такие лиганды как молекулы Н2О, NH3, CO, NO и др. и ноны CN−, F−, Cl−, OH−, SCN−, и др.
Бидентатныелиганды. К такому типу лигандов относятся ионы H2N—CH2—COO−, СО32−, SO42−, S2O32−, молекула этилендиамина H2N—CH2—CH2—H2N (сокращенно en).
Полидентатныелиганды. Это, например, органические лиганды, содержащие несколько групп — CN или -COOH (ЭДТА). Некоторые полидентантныелиганды способны образовать циклические комплексы, называемые хелатными (например, гемоглобин, хлорофилл и др.)
 2018-02-13
2018-02-13 1820
1820