| Фактор | Роль при культивировании | Методы управления фактором |
| Состав и концентрация питательных веществ | Обеспечивает метаболизм | Составление оптимальной композиции; подпитка во время ферментации; непрерывность процесса; многостадийность с учетом потребностей продуцента по фазам развития и др. |
| Концентрация продуктов и ингибиторов | Замедляет биохимические реакции | Осаждение продукта по мере накопления; ферментация с диализом; ферментация под разрежением с испарением летучего продукта и др. |
| рН | Оптимизирует скорости биохимических реакций | Регулирование путем добавления кислоты или щелочи |
| Температура | Оптимизирует скорости биохимических реакций | Охлаждение или подогрев культуральной жидкости при помощи теплообменников или температуры подаваемых в биореактор субстратов |
| Осмотическое давление или активность воды | Определяет границы жизни (составляет 0,6-0,998) | Составление сред с оптимальной концентрацией питательных веществ или влажностью твердой среды; поддержание на постоянном уровне во время ферментации путем разбавления водой или добавлением отдельных компонентов |
| Содержание растворенного кислорода | Для аэробов обеспечивает аэробный метаболизм; является акцептором Н+; ингибирует развитие анаэробов | Для аэробных процессов регулируют интенсивностью аэрации или добавлением к газовой смеси кислорода. Анаэробные процессы реализуют в бескислородной среде |
| Содержание диоксида углерода | Источник углерода для автотрофов; некоторые гетеротрофы нуждаются, а некоторые замедляют метаболизм в присутствии СО2 | Продувание в фотосинтезирующих процессах ферментации газовой средой, обогащенной СО2; выделению СО2 из жидкой фазы способствует перемешивание |
| Перемешивание среды | Равномерное распределение питательных веществ и биомассы по всему пространству среды | Организуют макро- и микроперемешивание при помощи механических мешалок, барботажных, циркуляционных и других систем |
| Вязкость среды | Определяет диффузию питательных веществ и перемешивание клеток продуцента | Регулирование компонентами питания, характером и концентрацией биомассы, наличием некоторых полимерных продуктов. Вязкость влияет на перемешивание и аэрацию; требуются специальные технические средства |
3. Список посуды и оборудования:
| Наименование | Объем | Количество |
| Мерная колба | 100 мл 25мл | 1 2 |
| Пробирка | 3 | |
| Пипетка - с отбитым носиком | 2 мл 1 мл 2 мл | 1 4 1 |
| Песочные часы | 1 |
4.Описание хода работы:
1) Постановка пробы на гидролиз
- берем коническую колбу (V=100 мл), добавляем 1 мл испытуемой пробы (в качестве испытуемой пробы у нас выступает приготовленная ранее среда), 5 мл 10 % раствора соляной кислоты, 9 мл дистиллированной воды.
- проводим гидролиз в автоклаве. Время гидролиза – 30 минут, избыточное давление – 0,15 Мпа. Пробу ставят на гидролиз для разложения полисахаридов на моносахариды (глюкозу), содержание которых будем определять впоследствии.
- после гидролиза проводим охлаждение пробы, дальше нейтрализацию содой (добавляем соду, пока из пробы не перестанет выделяться углекислый газ).
- после нейтрализации разбавляем пробу в 5 раз (1 мл пробы и 4 мл воды), согласно варианту нашего задания.
Схематическое пояснение:
2) Определение глюкозы в пробе
- наливаем в пробирку 2 мл пробы, добавляем 1 мл 0,3% раствора хлористого 2,3,5 – трифенилтетразолия, 1 мл 1 н раствора едкого натрия.
- нагреваем полученную смесь на горячей водяной бане в течение трех минут (время измеряем по песочным часам), появляется вишневое окрашивание за счет образования нерастворимого комплекса.
- пробу охлаждаем, добавляем в нее 1 мл 2,1 н раствор уксусной кислоты.
- содержимое пробирки переносим в мерную колбу, объемом 25 мл, смывая остатки раствора изопропиловым спиртом. Оптическую плотность окрашенных растворов измеряем на фотоэлектроколориметре КФК – 2, длина волны – 490 нм. Готовим раствор сравнения аналогичным образом, только вместо 2 мл пробы берем 2 мл дистиллированной воды.
По градуировочной зависимости оптической плотности раствора от количества глюкозы определяем ее содержание в анализируемой формуле. Расчеты проводят по следующей формуле:
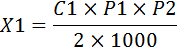
где Х1 — содержание глюкозы в 1 мл исследуемой пробы;
С — содержание глюкозы в анализируемом растворе, определенное по калибровочной кривой, мкг;
Р1 — разведение пробы при постановке ее на гидролиз;
P2 — разведение пробы перед анализом;
2 — количество исследуемого раствора, взятое для анализа,
мл;
1000 — перевод мкг в мг.
X1 = (120 мкг*5*15)/2*1000=4,5 мг/мл
Схематичное пояснение:
3) Посев продуцента антибиотика с косяка в жидкую питательную среду (засевали 2 качалочные колбы на подгруппу)
-соблюдая все правила асептики, берем бактериологический крючок, захватываем им культуру микроорганизма вместе с питательной средой и переносим в качалочную колбу.
-проводим качалку (время 200-220 минут), температура помещения – 26-28 С.
- продолжительность ферментации – 5 суток (120 часов).
Схематичное пояснение:
4)Подготовка агаризованной среды для посева на нее микроорганизма — продуцента антибиотика
- колбу со стерильной агаризованной помещаем на водяную баню для расплавления агар-агара.
- немного охлаждаем расплавленный агар-агар, переливаем его в чашки Петри, все операции выполняем асептично!
- агар-агар застывает.
Схематичное пояснение:
5)Посев культуры-продуцента антибиотика с косяка на агаризованную среду в чашки Петри
- соблюдая правила асептики, микробиологической петлей берем культуру и переносим ее на чашки Петри с застывшим агар-агаром. Зигзагообразными движениями переносим культуру на чашку Петри.
- чашки Петри ставим в термостат на 28 С, продолжительность выращивания продуцента 8 – 10 суток.
Схематичное пояснение:
6) Посев культуры продуцента фермента на сыпучий субстрат
Посев микроорганизма-продуцента фермента на сыпучий субстрат осуществляют взвесью спор гриба стерильной пипеткой.
Взвесь спор гриба готовили путем смыва спор микрoорганизма с поверхности агаризованной среды физиологическим раствором, которую затем перелили в стерильную колбу.
- соблюдая правила асептики, взвесь спор гриба вместе с физиологическим раствором вносят в колбу с перловой крупой и орошают сыпучий субстрат.
Схематичное пояснение:
5.Выводы и результаты:
Наша команда усвоила теоретическую часть занятия, после чего согласно методическим указаниям успешно провела анализ содержания редуцирующих сахаров в жидкой питательной среде.
Также в ходе работы мы произвели посев продуцента на питательные среды, соблюдая при командной работе правила асептики. Мы с нетерпением ждем следующего занятия, на котором мы сможем реально оценить насколько асептично работали.
 2018-02-13
2018-02-13 953
953







