Для систем представляющих собой фазовый переход – это состояние термодинамического равновесия, чаще всего оно реализуется на границе раздела фаз (случай б). Это можно пояснить, используя основное положение неравновесной термодинамики, которое гласит, что существует бесконечно малый объем, в котором система находится в равновесии. Используя это положение, статистическая физика показывает, что если в системе нет резких сильных источников энергии, то в близи раздела фазы существует граница, где обе фазы находятся в равновесии, даже если в общем объеме фазы находятся в состоянии далеком от равновесного. Чем дальше фазы от состояния равновесия, тем тоньше эта граница. Это положение в литературе известно как «закон локального сохранения фаз». Опытным путем было показано, что отклонение от этого закона реализуется только в технологических системах получения материала в космосе и ядерных реакциях, а также при применении мощных лазеров пико- и наносекундных импульсов. Во всех остальных случаях закон локального равновесия фаз не нарушается, и мы можем им пользоваться без объяснений и доказательств. Наиболее интересны возможности по применению этого закона для моделирования роста лазерных кристаллов и технологий обработки лазером различных поверхностей. Он позволяет во многих случаях ограничиться моделированием системы (объекта, процесса) только в равновесном приближении.
В начале рассмотрим процессы, в которых происходит равновесный переход из одного фазового состояния в другое, например, из жидкого в твердое. В этом случае можно предположить, что при изменении температуры скорость установки равновесия гораздо больше градиента температуры и скорости теплового потока. В этом случае систему можно представить как систему, в которой в каждый момент времени существует локальное равновесие фаз, а зависимость температуры от времени является скачкообразной.
Определение 9 Система, которая в каждый момент времени может быть описана уравнением состояния, называется квазиравновесной.
При моделировании равновесных и квазиравновесных систем мы полагаем отсутствие движения потоков внутри системы, таким образом, уравнения (2.5) – (2.6) представляют тождественное равенство, и задача сводится к решению уравнений на границе раздела.

 (2.5)
(2.5)
или
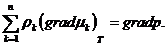 (2.6)
(2.6)
Таким образом, уравнение (2.5) представляет собой просто уравнение сохранения химического потенциала и для системы, состоящей из r фаз и n компонентов разбивается на систему уравнений следующего вида:
 (2.9)
(2.9)
где μ - химический потенциал компонента в фазе;
индексы i и j относятся к номерам компонент;
индекс k – к номеру фазы.
Таким образом, на примерах для системы состоящей из трех компонент и двух фаз, мы можем записать шесть уравнений для диаграммы состояний.
Одноко не все уравнения в даной системе являются независимыми. Количество независимых уравнений определяется правилом Гиббса:
f=r+n-2, (2.10)
где f - степень свободы системы.
Поэтому из этих уравнений можно выбрать любые в количестве, определяемом степенью свободы системы.
Рассмотрим в качестве прмера моделирование кристаллического роста многокомпоненнтной системы, состоящей из различных типов полупроводниковых материалов Химическое равновесие в вышеуказанной системе было рассчитано с использованием общих базовых методов минимизации общей энергии Гиббса системы, в наборе точек, удовлетворяющих условию материального баланса. Это модификация метода White – Johnson – Dantzig; В программе расчетов применен алгоритм ранее описанный Эриксоном[1].
Идеальное поведение газовой фазы принято во всех расчетах и следующие газовые вещества были включены в процедуру вычисления:Ga, Ga(CH3)3, Ga(CH3), GaH3, GaH2, GaH, As2, As3, As4, AsH3, CH4, C2H6, C2H4 и H2. Эти вещества были отобраны на базе наших предварительных вычислений и результатов опубликованных в литературе[1]. Три осажденных фазы были дальше взяты в расчеты: GaAs(s), (Ga-As) расплав и твердый углерод. Твердый арсенид не был рассчитан, т.к. пар арсенида при вышеуказанном давлении As(s) всегда выше в пределах температурного диапазона[1], чем для арсенида, сформированного диссоциацией AsH3 в атмосферном водороде.
Введение термодинамических данных для индивидуальных веществ стандартных молярных энергий Гиббса,G0i(T) которые указаны в табл.1. для всех соединений. Эти значения для газообразных веществ были рассчитаны для стандартного теплообразования DH0f 298К, стандартной молярной энтропии S0 и температуры, зависящей от молярного теплоемкости,Cp=f(T) которые были взяты из единого источника [10] для всех веществ включительно, чтобы гарантировать внутреннюю плотность. Значения для твердого GaAs были рассчитаны для DH0f(GaAs, s, 298K) и S0 (GaAs, s, 298K), опубликованных Tmar и другие [1] и с температурной зависимостью, взятой из таблицы Barin и другие [1]. Данные для Ga(l), As(s) и С(s) так же взяты из этих таблиц. Расчет стандартной молярной энергии Гиббса для жидкого As, температурной зависимости молярной энергии слияния Гиббса для чистого арсенида, опубликованные Gokcen [1] были в дальнейшем использованы.
Табл.1.
Активные коэффициенты для бинарных соединений решены, затем даны:
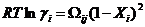 (1.1.1)
(1.1.1)
где Wij - параметр взаимодействия в i-j бинарной системе, который зависит от состава взаимодействия, но может, в основном, быть функцией температуры. Значение WGa-As=7782 – 25.1T(Дж/моль) было использовано и было получено для оптимизации анализов опубликованных экспериментальных данных равновесия расплав - твердая фаза в системе GaAs в температурном диапазоне 600 – 8000С [1].
Основная проблема при решении диаграмм состояния заклюяается в том, что для многих систем неизвестны экспериментальные входные параметры, особенно для многокомпонентных составов, такие как энтропия, энтальпия системы в заданной точке, параметры связи компонентов системы (коэффициент активности). Принято моделировать системы в типовых приближениях, полагая, что коэффициент активности можно представить в виде многочлена n -й степени, зависящего от температуры и состава, при этом, как и в обычной термодинамике, предполагается, что в газовой фазе коэффициент активности постоянен. Если концентрация компонента близка концентрации примеси, то уравнение для этого компонента записывается как уравнение идеального газа.
В остальных случаях коэффициенты активности описываются функциями подобранными экспериментально. Для бинарных твердых растворов материалов наиболее часто спользуемых в промышленности эти функции известны. Для многокомпонентных систем предаолагается, что они являются функциями состава в целочисленной степени. если эта функция линейна, то такое описние диаграммы состояний называется «приближение простых растворов».
Таким образом, диаграму состоянии можно представить в виде системы транцендентых уравнений относительно составов содержащихся в них компонент. При моделировании равновесного состояния возникают два типа трудностей: первая трудность связана с подбором экспериментально определяемых констант, вторая - с наличием точек разрывов первого и второго рода на диаграмме состояний. точки разрывов очень часто показывают области, где система перестает быть принципиально равновесной, и, как следстве, ее реализация не осуществима на оборудовании, работающем в низкоэнергетических режимах передачи энергии.
Очень важное значение имеют градиенты составов по температуре ( ) и другим компонетам (
) и другим компонетам ( ). Первый градиент пропорционален скорости роста фазы, второй носит название «коэффициент сегрегации» и определяет сколько компонент одного вещества можно ввести в систему.
). Первый градиент пропорционален скорости роста фазы, второй носит название «коэффициент сегрегации» и определяет сколько компонент одного вещества можно ввести в систему.
Рассмотрим в качесве примера моделирование технологического процесса выращивания полупроводникового лазера методом жидкофазной эпитаксии.
 2018-02-13
2018-02-13 394
394








