Растворы – это термодинамически устойчивая однородная гомогенная система, состоящая из двух или большего числа компонентов. Важной характеристикой любого раствора является его состав, который выражается концентрацией.
Процентная концентрация раствора по массе показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора. Процентная концентрация - это безразмерная величина и выражается соотношением
С%= 100  (1.30)
где С – концентрация раствора, %;
m1 – масса растворенного вещества, г, кг;
m – масса раствора.
Масса раствора равна произведению объема раствора V на его плотность (1.30)
где С – концентрация раствора, %;
m1 – масса растворенного вещества, г, кг;
m – масса раствора.
Масса раствора равна произведению объема раствора V на его плотность 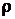 : m=V : m=V 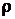 , тогда
С%= 100 , тогда
С%= 100  Молярная по массе концентрация раствора (молярность раствора) показывает число молей растворенного вещества, содержащихся в 1 л раствора.
Молярная концентрация (моль/л) выражается формулой
См= m/ (MV)
где m –масса растворенного вещества, г;
М – молярная масса растворенного вещества, г/ моль;
V – объем раствора.
Нормальная по массе концентрация раствора (нормальность раствора) показывает число грамм – эквивалентов растворенного, вещества, содержащихся в 1 л раствора (г- экв/л)
Сн=
Молярная по массе концентрация раствора (молярность раствора) показывает число молей растворенного вещества, содержащихся в 1 л раствора.
Молярная концентрация (моль/л) выражается формулой
См= m/ (MV)
где m –масса растворенного вещества, г;
М – молярная масса растворенного вещества, г/ моль;
V – объем раствора.
Нормальная по массе концентрация раствора (нормальность раствора) показывает число грамм – эквивалентов растворенного, вещества, содержащихся в 1 л раствора (г- экв/л)
Сн= 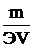 (1.33)
где m – масса растворенного вещества, г;
Э – эквивалентная масса растворенного вещества, г/ экв;
V – объем раствора, л.
Молярная (по массе) концентрация раствора (молярность раствора) показывает число молей растворенного вещества, приходящегося на 1 кг растворителя.
Размерность моляльной концентрации (1.33)
где m – масса растворенного вещества, г;
Э – эквивалентная масса растворенного вещества, г/ экв;
V – объем раствора, л.
Молярная (по массе) концентрация раствора (молярность раствора) показывает число молей растворенного вещества, приходящегося на 1 кг растворителя.
Размерность моляльной концентрации
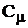 = m1/ ( = m1/ ( ), (1.34)
где ), (1.34)
где 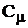 - моляльная концентрация, моль/ кг;
m1 – масса растворенного вещества, г;
m1 – масса растворителя, кг;
М – моль растворенного вещества, г.
Титр раствора Т показывает количество граммов растворенного вещества, содержащегося в 1 мл раствора. - моляльная концентрация, моль/ кг;
m1 – масса растворенного вещества, г;
m1 – масса растворителя, кг;
М – моль растворенного вещества, г.
Титр раствора Т показывает количество граммов растворенного вещества, содержащегося в 1 мл раствора.
|
 2018-02-13
2018-02-13 594
594








