В природе не существует идеальных газов.
Однако различие в свойствах идеального газа и реальных газов может быть больше или меньше в зависимости от условий, в которых находится реальный газ.
При относительно низких давлениях и относительно высоких температурах, в пределах которых протекает работа всех современных тепловых машин, это различие в свойствах реальных газов и идеального настолько мало, что не имеет практического значения и в термодинамических расчётах обычно во внимание не принимается. Поэтому эти газы (рабочие тела) рассматриваются как идеальные газы.
В других условиях (высокие давления, низкие температуры, в областях насыщения и вблизи критической точки) эти газы по своим свойствам значительно отличаются от идеального газа и поэтому не могут рассматриваться как идеальные.
Таким образом, один и тот же газ в зависимости от условий, в которых он находится, может рассматриваться или как идеальный или как реальный.
1.2.2. Законы идеальных газов
В период с 1662г. по 1802г. открыто 3 закона:
Закон Бойля – Мариотта. При постоянной температуре произведение абсолютного давления и удельного объёма есть величина постоянная
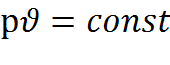 (2.1)
(2.1)
Закон Гей– Люсса ка.
При постоянном давлении удельный объём идеального газа изменяется прямопропорционально изменению абсолютных температур
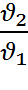 =
= 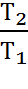 (2.2)
(2.2)
Закон Шарля
При постоянном удельном объёме абсолютное давление идеального газа изменяется прямопропорционально изменению абсолютной температуры
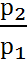 =
= 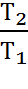 (2.3)
(2.3)
 днако эти законы устанавливают связь между двумя параметрами при const третьего. В реальных процессах чаще встречаются случаи изменения сразу всех трёх параметров.
днако эти законы устанавливают связь между двумя параметрами при const третьего. В реальных процессах чаще встречаются случаи изменения сразу всех трёх параметров.
Данное уравнение устанавливает связь между тремя основными параметрами (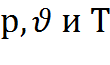 ) идеального газа.
) идеального газа. 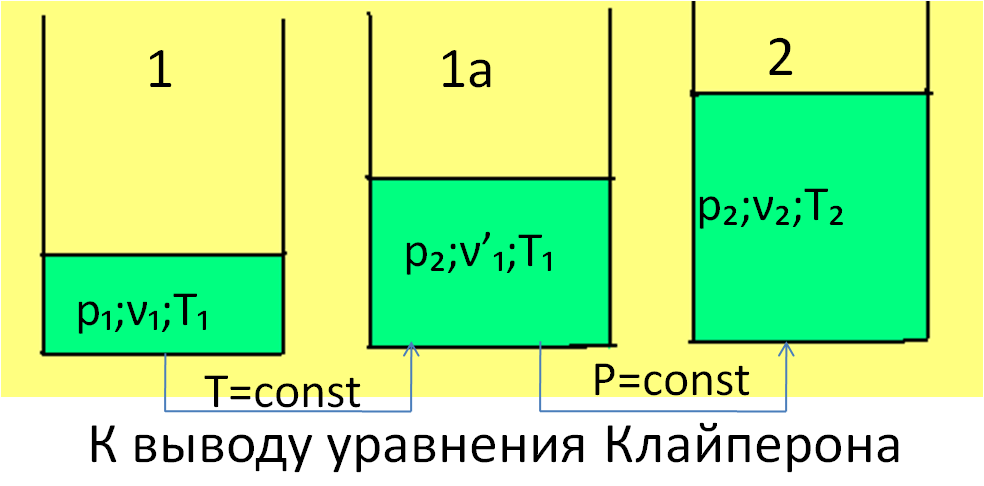
Допустим, что в цилиндре 1кг газа расширяется из состояния 1 в состояние 2, при этом переход осуществляется сначала при 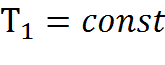 , а затем при
, а затем при 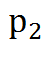 =const.
=const.
При первом переходе
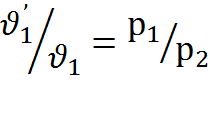 откуда
откуда 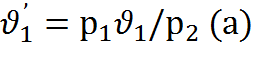
при втором переходе
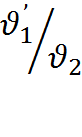 =
= 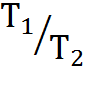 откуда
откуда 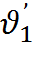 =
= 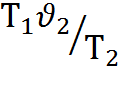 (б)
(б)
решая совместно (а) и (б) получим
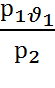 =
= 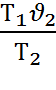
сгруппируем члены
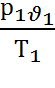 =
= 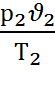
начальное и конечное состояние газа выбраны произвольно, поэтому
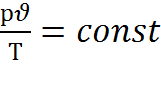 р
р 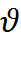 /T=R – УДЕЛЬНАЯ ГАЗОВАЯ ПОСТОЯНН
/T=R – УДЕЛЬНАЯ ГАЗОВАЯ ПОСТОЯНН
р 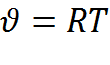 для m=1кг (2.4)
для m=1кг (2.4)
(2.4)– уравнение состояния идеального газа или уравнение Клайперона (1834г.)
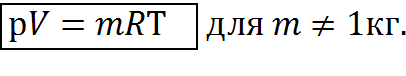 (2.5)
(2.5)
Физический смысл удельной газовой постоянной
Запишем уравнение (2.4) для начального и конечного состояния для процесса р=const
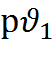 =R
=R 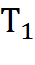 и р
и р 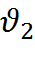 =RТ₂
=RТ₂
вычитая первое уравнение из второго, получим 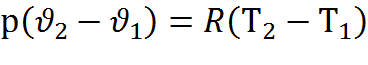 отсюда
отсюда
R= 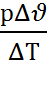 , но р
, но р 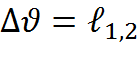 – удельная термодинамическая работа. Тогда
– удельная термодинамическая работа. Тогда
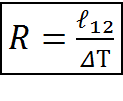 (2.6)
(2.6)
Следовательно, удельная газовая постоянная является удельной термодинамической работой газа в процессе постоянного давления при изменении температуры на один градус.
Единица измерения R вытекает из (2.6)
R[Дж/(кг 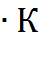 )]
)]
Рассмотрим, как можно определить численноезначение R. Для этого воспользуемся следствием закона Авогадро: «Различные газы, взятые при одинаковых давлениях (р) и температуре (Т), и имеющие одинаковое количество молекул (N), занимают одинаковые объёмы (V)».
Введём понятия
– киломоль это масса газа М (в кг), численно равная молярной массе 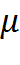 ;
;
– молярная масса-отношение массы вещества к его количеству [кг/кмоль].
Примем М₁=μ₁ и М₂=μ₂
в соответствии со следствием закона
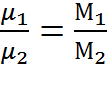 =
= 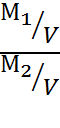 =
= 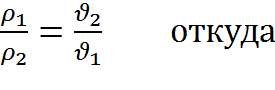
μ₁ 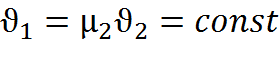
произведение μ 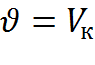 – объём одного киломоля газа.
– объём одного киломоля газа.
Чтобы получить уравнение состояния для 1 киломоля газа умножим обе части уравнения (2.4) на молярную массу
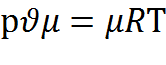 но
но 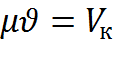 тогда
тогда
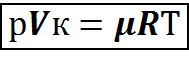 (2.7)
(2.7)
Это уравнение состояния для 1киломоля газа выведено Д.И. Менделеевым и называется уравнением Клайперона - Менделеева.
Из (2.7) следует, что 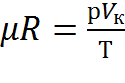 и согласно следствию закона Авогадро является одинаковой величиной для всех газов.
и согласно следствию закона Авогадро является одинаковой величиной для всех газов.
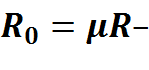 универсальная газовая постоянная.
универсальная газовая постоянная.
Уравнение Клайперона-Менделеева будет выглядеть
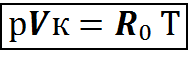 (2.8)
(2.8)
Вычислим значение универсальной газовой постоянной. Для этого воспользуемся стандартными физическими условиями: р=101325Па; Т=273,15К; Vк=22,4м³/кмоль.
R₀=R 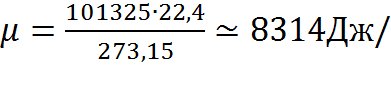 (кмоль
(кмоль  К)
К)
Удельная газовая постоянная определится
R= 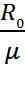 =
= 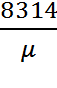 Дж/(кг∙К).
Дж/(кг∙К).
 2018-02-13
2018-02-13 1439
1439








