Согласно молекулярно-кинетической теории, реальные газы состоят из молекул, обладающих объёмом и находящихся в непрерывном движении. Между молекулами существуют силы взаимодействия – притяжения или отталкивания. Из физики известно, что реальные газы могут быть сжижены. Иначе говоря, реальные газы – это перегретые пары определённых жидкостей.
В технике широко применяются пары различных жидкостей: воды, аммиака, фреона, углекислоты и т.д. Чем ближе газ к переходу в жидкое состояние, тем больше его термодинамические свойства отличаются от свойств идеального газа.
Уравнение состояния реальных газов было получено в 1873 году Ван-дер-Ваальсом. Оно имеет вид
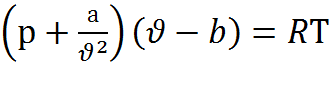 , (2.9)
, (2.9)
где а и b–поправки, зависящие от природы газа, находятся опытным путём. Уравнение (2.9) отличается от (2.4) двумя поправками:
– 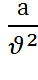 учитывает силы взаимодействия молекул и называется молекулярным давлением (оно уменьшает реальное давление);
учитывает силы взаимодействия молекул и называется молекулярным давлением (оно уменьшает реальное давление);
– b несжимаемый объём (объём самих молекул), разность (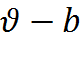 ) – свободное пространство, в котором могут двигаться молекулы.
) – свободное пространство, в котором могут двигаться молекулы.
Это уравнение качественно правильно отражает свойства реальных газов, однако, для количественных расчётов оно недостаточно точно, особенно для газов с высокими давлениями и низкими температурами.
В настоящее время предлагается более точное уравнение состояния реальных газов
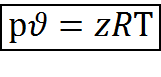 , где (2.10)
, где (2.10)
z– коэффициент сжимаемости газов.
ТЕМА 1.3. СМЕСИ ПАРОВ И ГАЗОВ
1.3.1. Понятие о смесях.
В технике в качестве рабочего тела часто используются газовые смеси (воздух, природный газ, продукты сгорания топлив и т.д.).
 2018-02-13
2018-02-13 220
220








