316. Напишите структурные формулы следующих аминокислот:
| а) 5-амино-2,3диметилгексановой; | |
| б) 2,7 - диамино - 3,4,5 - триметилгептановой. | |
317. Напишите структурные формулы изомерных аминокислот, соответствующих составу C3H7O2N. Назовите их.
318. Напишите формулы структурных изомеров аминокислот C4H9O2N и укажите изомеры:
| а) с первичной аминогруппой; | б) со вторичной аминогруппой. |
319. Напишите уравнения реакций, которые подверждают амфотерность валина (2-амино-3-метилбутановой кислоты). Какие свойства (основные или
кислотные) будут преобладать у аспаргиновой кислоты (2-аминобутандиовой кислоты)?
320. Предложите способ получения этилового эфира аминоуксусной кислоты, исходя из ацетилена и неорганических веществ?
321. Предложите способ получения аланина из пропанола-1 и неорганических веществ.
322. За счёт чего происходит образование дипептидов? Напишите уравнение реакций между a-аминоуксусной и a-аминопропионовой кислотами.
323. Что происходит при нагревании следующих аминокислот:
| а) a- и b-аминопропионовых; | б) a-, b-, g-аминомасляных; |
| в) a- и b- аминоизомасляных. | |
324. Сколько трипептидов может быть получено из трёх аминокислот: цистена; аланина; лизина? Приведите структуры двух возможных трипептидов.
325. В результате мягкого гидролиза некоего трипептида образовались (кроме индивидуальных аминокислот) два дипептида: аланин-валин и
валин-изолейцин. Какова структура исходноготрипептида?
326. Сколько тетрапептидов могут образовать четыре разных аминокислоты? Сколько продуктов получится при неполном гидролизе любого из этих пептидов?
327. Определите формулу сложного эфира аминоуксусной кислоты, массовая доля кислорода в котором равна 31,07 %.
328. Напишите уравнения реакций между валином (2 – амино – 3 – метилбутановой кислотой) и следующими веществами:
| а) гидроксидом натрия; | б) бромоводородной кислотой; |
| в) метанолом (в присутствии каталитических количеств сильной кислоты). | |
329. Напишите уравнения реакций, доказывающих амфотерный характер аланина (2-аминопропионовой кислоты). Почему не изменяется цвет индикатора лакмуса в водном растворе аланина?
330. Напишите уравнения реакций, которые надо провести для осуществления следующих превращений:
CH3COOH ® А ® NH2 – CH2COOH ® Б ® [CH3NH3]Cl
Назовите вещества А и Б.
331. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

332.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

При каких условиях протекают эти реакции.
333.Напишите структурные формулы следующих пептидов:
| а) глицил-аланил-лейцина; | б) валил-аланил-глицина; |
| в) глицил-фенилаланил-валина. | |
334. Назовите вещество, которое образуется, если продукт реакции взаимодействия аланина с хлорангидридом бромуксусной кислоты подвергнуть действию избытка аммиака. Напишите уравнения реакций.
335. Аминоуксусная кислота получена из уксусной кислоты массой 24 г (массовая доля выхода 70 %). Вычислите объем раствора гидроксида натрия (массовая доля NaOH 15 %, плотность 1,16 г/мл), который потребуется для нейтрализации полученной аминоуксусной кислоты.
336. Вычислите минимальный объем аммиака, который надо пропустить через раствор хлоруксусной кислоты массой 250 г (с массовой долей 25 %) для полного превращения её в аминоуксусную кислоту.
337. Вычислить массу 25 %-ного раствора аминоуксусной кислоты, которую можно получить из 15 г уксусной кислоты двухстадийным синтезом с выходом продукта на каждой стадии 80 %.
338. Напишите уравнения реакций, с помощью которых можно из карбида кальция и неорганических веществ в несколько последовательных стадий получить аминоуксусную кислоту. Вычислите массу полученной кислоты, если был использован технический карбид массой 80 г (массовая доля СаС2 80 %).
339. Из уксусной кислоты массой 54 г получена хлоруксусная кислота, массовая доля выхода продукта составила 75 %. Через раствор хлоруксусной кислоты пропущен аммиак объемом 13,5 л. Вычислите, сколько аминоуксусной кислоты было получено.
340. Смесь массой 30 г, состоящая из метиламина, аминоуксусной кислоты и этилацетата может прореагировать с хлороводородом объёмом 7,4 л (н.у.). Та же смесь массой 40 г может прореагировать с 300 мл 1,4М раствора гидроксида калия. Вычислите массовые доли веществ в исходной смеси.
341. При нагревании аминокислоты массой 8,24 г выделился газ объёмом 1792 мл. Сколько мл 6 % раствора соляной кислоты (плотностью 1,03 г/мл) было израсходовано на его нейтрализацию?
342. Из уксусной кислоты массой 30 г с выходом 60% получили аминоуксусную кислоту. Какой объем раствора гидроксида калия с массовой долей 0,12 и плотностью 1,1 г/мл необходим для реакции с полученной аминоуксусной кислотой?
343. Вычислите массу 15 % - го раствора аминоуксусной кислоты, которую можно получить из 15 г уксусной кислоты двухстадийным синтезом с выходом продукта на каждой стадии, равным 75 %.
344. К 150 г 5% - го раствора аминоуксусной кислоты добавили 100 г 5 % - раствора гидроксида калия. Определите массовые доли веществ в полученном растворе.
345. Какой объем аммиака потребуется для превращения бромуксусной кислоты массой 27,8 г в глицерин, если потеря аммиака составляет 5 %.
346. Массовая доля кислорода в одноосновной аминокислоте равна
42,67 %. Установите молекулярную формулу кислоты.
347. Установите молекулярную формулу третичного амина, если известно, что при его сгорании выделилось 0,896 л (н.у.) углекислого газа, 0,99 г воды и 0,112 л (н.у.) азота.
348. Из уксусной кислоты массой 108 г получена хлоруксусная кислота, массовая доля выхода продукта составила 75 %. Через раствор хлоруксусной кислоты пропущен аммиак объемом 27 л. Вычислите, сколько аминоуксусной кислоты было получено.
349. При взаимодействии α-аминопропановой кислоты массой 44,5 г с гидроксидом натрия образовалась соль массой 50 г. Рассчитайте массовую долю выхода соли.
350. Определите молекулярную формулу аминокислоты, массовые доли углерода, кислорода и азота в которой составляют 32; 6,66; 42,67 и 18,67 %.
Напишите структурную формулу этой аминокислоты и назовите ее.
УГЛЕВОДЫ
Углеводы – один из основных классов органических соединений, встречающихся в природе. Их общая формула Cn(H2O)m (n,m ³ 3).
Углеводы подразделяют на три большие группы.
I) Моносахариды, или простые сахара (виноградный сахар, плодовый сахар).
Это такие углеводы, которые не могут гидролизоваться с образованием более простых углеводов. Простейший моносахарид – глицериновый альдегид – С3Н6О3

Остальные моносахариды по числу атомов углерода подразделяются:
1) на тетрозы (С4Н8О4);
2) на пентозы (С5Н10О5);
3) на гексозы (С6Н12О6).
К важнейшим гексозам относятся глюкоза, фруктоза, галактоза, манноза:

II) Олигосахариды – продукты конденсации небольшого числа моносахаридов. К важнейшим олигосахаридам состава С12Н22О11 относятся:
1) сахароза – С12Н22О11(состоит из остатков D-глюкозы и D-фруктозы);
2) мальтоза – (состоит из 2 остатков D-глюкозы);
3) лактоза – (состоит из остатков D-галактозы и D-глюкозы).
III) Полисахариды образованы большим числом молекул моносахаридов. В частности, крахмал, целлюлоза состоят из остатков D-глюкозы.
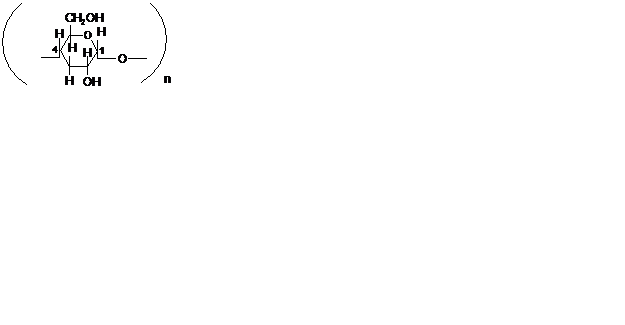

крахмал целлюлоза
Глюкоза
Глюкоза – по своей распространённости намного превосходит остальные моносахариды. В свободном виде встречается во фруктах, растениях, мёде, в крови и моче, в связанном виде – во многих гликозидах, дисахаридах и полисахаридах. Глюкоза – это белые кристаллы, сладкие на вкус, хорошо растворимые в воде.
В линейной форме молекулы глюкозы содержат одну альдегидную группу и пять гидроксильных групп. В кристаллическом состоянии молекулы глюкозы находятся в одной из двух циклических форм (a-глюкоза или b-глюкоза), которые образуются из линейной формы за счёт взаимодействия гидроксильной группы при 5-м атоме углерода с карбонильной группой.
Буква a в названии циклических форм моносахаридов означает, что группа -ОН при первом углеродном атоме и группа –СН2ОН при шестом углеродном атоме находятся по разные стороны от плоскости кольца.
В b-сахаридах эти группы находятся по одну сторону от плоскости кольца:

Данное равновесие существует в водном растворе.
Процесс образования циклических форм глюкозы из линейной можно представить следующим образом. Атом водорода группы –ОН при 5-м атоме углерода перемещается к атому кислорода альдегидной группы −СН=О, а между атомами С(1) и С(5) устанавливается связь через атом кислорода с образованием шестичленного цикла:

Шестичленный цикл называется пиранозным.
Если во взаимодействие с альдегидной группой вступает группа –ОН при 4-м атоме углерода, то образуется пятичленный цикл, который называется фуранозный (фруктоза).
Группа –ОН при первом углеродном атоме в циклических формах называется гликозидным гидроксилом. Эта группа резко отличается по свойствам от остальных четырёх гидроксильных групп.
В молекуле глюкозы присутствуют гидроксильные группы, а в линейной форме присутствует альдегидная группа. По этим группам происходят химические взаимодействия.
I. Реакции по альдегидной группе:
1) Глюкоза вступает в реакцию с аммиачным раствором оксида серебра

2) Глюкоза при нагревании окисляется гидроксидом меди (II) в глюконовую кислоту

3). При восстановлении альдегидной группы глюкоза образует шестичленный спирт – сорбит

II. Реакции по гидроксильным группам
4) С гидроксидом меди (II) без нагревания глюкоза реагирует как многоатомный спирт и при этом образуется комплекс с характерным синим окрашиванием:

5) При действии метилового спирта в присутствии катализатора (HCl) гликозидный гидроксил замещается на группу ОСН3 и образует монометиловый эфир глюкозы:

6) Молекулы глюкозы способны к расщеплению под действием различных микроорганизмов. Эта реакция называется брожением.
а) спиртовое брожение:

б) молочнокислое брожение:

в) маслянокислое брожение:

 2018-02-14
2018-02-14 1228
1228








