Ионы водорода. Величина концентрации водородных ионов является важнейшей характеристикой природных вод, так как ионы Н+ играют исключительную роль в гидрогеохимических процессах. Многие сложные преобразования химического состава подземных вод проходят при активном участии ионов Н+.
Известные свойства кислот независимо от их анионов будут характеризоваться наличием положительно заряженного иона водорода. Основания же независимо от катионов при электролитической диссоциации воды образуют гидроксильные ионы ОН--, имеющие отрицательные заряды.
Концентрацию водородных ионов выражают в виде логарифмов, взятых с обратным знаком, и обозначают символом рН. При рН=7 реакция воды нейтральная. При рН менее 7 реакции кислая, при рН более 7 — щелочная.
Ион Н 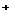 , как таковой, не существует в водном растворе. Присоединяя одну молекулу воды, он гидратируется, образуя ион гидроксония Н
, как таковой, не существует в водном растворе. Присоединяя одну молекулу воды, он гидратируется, образуя ион гидроксония Н  О
О 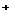 . Размеры гидроксония (1,35
. Размеры гидроксония (1,35  ) по сравнению с другими гидратированными ионами (например, Са=10
) по сравнению с другими гидратированными ионами (например, Са=10  ) очень малы. В этом заключается причина высокой активности водорода. Ионы водорода способны внедряться в кристаллическую решетку минералов, вытесняя из нее другие катионы. Кроме того, водород адсорбируется коллоидами сильнее всех одновалентных и даже двухвалентных ионов.
) очень малы. В этом заключается причина высокой активности водорода. Ионы водорода способны внедряться в кристаллическую решетку минералов, вытесняя из нее другие катионы. Кроме того, водород адсорбируется коллоидами сильнее всех одновалентных и даже двухвалентных ионов.
|
|
|
Величина рН в подземных водах зависит от содержания в них различных форм угольной кислоты, от присутствия органических кислот, газов, микроорганизмов, от гидролиза солеи и т.д.
Для большинства природных вод величина рН определяется главным образом соотношением концентрации угольной кислоты и ее ионов. Угольная кислота в воде диссоциирует с образованием ионов Н+:.
Н2СО3↔Н++НСО3-↔2Н++СО3--
Угольная кислота является слабой кислотой и в нормальных условиях диссоцирует незначительно.
Для поверхностных вод, в которых содержание двуокисн углерода небольшое, характерна слабо щелочная реакция. Однако в случае наличия больших количеств двуокиси углерода и сравнительно небольших количеств НСО3-- рН может быть ниже 7,0. Гумусовые кислоты, присутствующие в кислых почвах, в перегное лесной подстилки и, особенно, в болотных водах, являются источником обогащения вод ионами водорода. Поэтому грунтовые воды лесной зоны имеют слабокислую реакцию.
Кислые воды образуются в результате гидролиза солей тяжелых металлов. При окислении сульфидов получаются сульфаты железа, меди, свинца и других металлов, которые гидролитически расщепляются. Например, гидролиз сульфата железа совершается по следующей схеме:
FeSO4+ 2Н2О=Fe(OН)2+2H++SО4--
Подобный процесс развивается в зоне окисления сульфидов металлов и особенно характерен для шахтных и рудничных вод. Экспериментальными исследованиями доказано, что процессы окисления при участии тионовых бактерии идут в 10—20 раз быстрее, чем в стерильной среде. Поэтому образование сильнокислых шахтных вод обязано деятельности кислот производящих бактерии.
|
|
|
Значения рН для подземных вод колеблются, от 0,45—1,0 до 8—11,5 Большинство природных вод имеет рН в пределах от 6 до 8,5. Наиболее низкие значения рН (0,45—3,0) связаны обычно с присутствием свободной серной, реже соляной кислоты. Понижения рН от 3,0 до 6,5 могут быть обусловлены, кроме присутствия серной кислоты, влиянием органических кислот и углекислого газа. Для нейтральных н слабощелочных вод (рН 6,5—8,5) характерно наличие в водах Са(НСО3)2 Мg(НСО3)2. Повышение рН до 8,5—10,5 в большинстве случаев связано с присутствием соды (Na2CO или NаНСО3). Наиболее высокие значения рН (до 11,5) характерны для термальных вод,
Подземные воды по величине рН рационально делить на семь групп.:
1. Сильнокислые воды с рН менее 3;
2. Кислые воды с рН от 3 до 5;
3. Слабокислые воды с рН от 5 до 6,5;
4. Нейтральные воды с рН от 6,5 до 7,5;
5. Слабощелочные воды с рН от 7,5 до 8,5;
6. Шелочные воды с рН от 8,5 до 9,5;
7. Сильнощелочные воды с рН более 9,5.
Кремнекислота. Кремний — второй по распространенности (после кислорода) элемент в земной коре. Он является постоянным компонентом состава природных вод. Однако из-за очень низкой растворимости силикатных минералов, а также благодаря тому, что кремнекислые соли являются питательным веществом для многих организмов, находящихся в воде, содержание кремния в водах очень невелико.
Кремний присутствует в водах в истинно растворенном состоянии в виде кремневой и поликремневых кислот, а также содержится в виде коллоидов типа хSiO2∙∙уН2О. Предполагают, что кремневая кислота имеет строение ортокремневой кислоты Н4SiO4. При диссоциации она образует ряд производных, из которых значение для природных вод может иметь лишь ион Н3SiO4-:
Н4SiO4↔Н++ Н3SiO4-
Повсеместное распространение в природе кремния обеспечивает и непрерывное поступление небольших количеств этого элемента в природные воды. Содержание кремнекислоты в подземных водах составляет обычно десятые доли, реже — несколько миллиграммов в литре. Относительно обогащены кремнекислотой сверхпресные воды северных районов, SiO2-нередко становится преобладающим компонентом в водах. К.В.Филатов выделяет класс силикатных грунтовых вод, которые являются устойчивыми в гипергенной зоне при самых слабых концентрациях (до 100 мг/л.) При повышении минерализации кремневая кислота вытесняется из раствора более сильной угольной кислотой:
Na4SiO4+4CO2+4H2O=4NaSiHCO3.
Реакция грунтовой воды при этом постепенно переходит от слабокислой к нейтральной и щелочной.
Лучше кремнекислота растворяется в щелочных термальных водах, в которых содержание ее достигает 100 и более миллиграммов в литре. Очень большие количества SiO2 обнаружены в гейзерах. При выходе воды гейзера на поверхность земли вследствие понижения температуры происходит выпадение SiO2 и образование мощных кремнистых туфов вблизи гейзера.
Сульфидные соединения. К сульфидным относятся соединения сероводорода, присутствующие в водах в виде молекулярно растворенного газа Н2S, а также в виде ионов сероводородной кислоты к ее солей (сульфидов). В природных водах Н  S может присутствовать в виде растворенного газа и в виде солей диссоциированной сероводородной кислоты.
S может присутствовать в виде растворенного газа и в виде солей диссоциированной сероводородной кислоты.
Н2S↔Н++НS-↔2Н++ S--
Б природных водах сульфиды, по сравнению с другими ингредиентами, находятся в малых количествах, однако содержание их в несколько мг/л придает воде специфические свойства (запах, вкус). В подземных водах Н2S — нередкое явление. В повышенных количествах, иногда до нескольких сотен миллиграммов на литр, он содержится в водах нефтяных месторождений и в минеральных источниках вулканических областей.
|
|
|
Появление сероводорода в природных водах обусловлено причинами органического и неорганического характера. Сероводород является одним из продуктов распада белкового вещества, содержащего в своем составе серу, и поэтому появление его часто наблюдается, в придонных слоях водоемов вследствие гниения различных органических остатков. Кроме того, сероводород может быть выделен из сульфатов восстановлением их в анаэробных условиях. Большие количества Н2S выделяются с вулканическими газами.
Соединения азота. Из соединений азота в подземных водах встречаются ионы аммония (NH4+), нитритный (NO2-) и нитратный (NO3-) ионы. Эти ионы генетически взаимосвязаны и могут переходить друг в друга. Содержание NH4+ в водах обычно выражается в сотых, реже — в десятых долях миллиграмма на литр. Повышенные количества NH4+, доходящие до нескольких миллиграммов на литр, в неглубоких подземных водах свидетельствуют о наличии органического загрязнения воды, так как аммоний образуется, главным образом, при процессах бактериального разложения органических веществ растительного и животного происхождения, содержащих в своем составе белок.
В очень больших количествах (до 100 мг/л н более) NH4+встречается в некоторых водах нефтяных месторождений. Столь значительные количества NH4+ образовались в результате анаэробного разложения некогда погребенного органического вещества. Вследствие закрытости нефтеносных структур ноны NH4+ в застойных условиях не подверглись нитрификации и сохранились до настоящего времени.
В обычных условиях ион аммония довольно неустойчив. В верхних зонах земной коры в присутствии свободного кислорода под влиянием бактерий, называемых нитрификаторами, аммоний переходит в нитриты по следующей реакции:
NH4++2О2→NО2-+2Н2O
На этом процесс нитрификации не заканчивается. Нитритные ионы весьма неустойчивы. В присутствии кислорода они окисляются до нитратов по реакции:
|
|
|
2NО2-+О2→2NО3-
Содержание NО2- в подземных водах не поднимается выше сотых или десятых долей миллиграмма на литр. Подобно аммонию ионы указывают на загрязнение подземных вод, причем, в отличие от 2NО3-, ноны 2NО3-, и NH4+ свидетельствуют о свежем загрязнении. Ион NО3+, являющийся конечным продуктом окисления азотистых соединений, указывает на старое загрязнение или на дальний источник загрязнении вод.
Несмотря на высокую растворимость нитратных солей, подвижность NО3-, весьма ограниченная вследствие усвоенния их растениями н процессов денитрификации, в пути. В верхних горизонтах подземных вод NО3- может содержаться в количестве до нескольких миллиграммов на литр. Только в специфических условиях (пустыни, крупные населенные пункты) нитраты способны скапливаться в грунтовых водах. В пустынях Средней Азии с подобными водами связаны нитратные солончаки. Наиболее глубоких водоносных горизонтах нитраты либо отсутствуют, либо количества их выражаются сотыми долями миллиграмма на литр.
В зонах затрудненного водообмена и застойного режима процессы нитрификации резко сокращаются и денитрификаторы разлагают нитриты и нитраты с выделением свободного азота по следующей схеме:
2НNО3→2НNО2 →2НNО→ N2.
Железо и алюминий. Железо и алюминий относятся к числу наиболее распространенных элементов в литосфере. Среднее содержание железа в земной коре составляет 4,65%, алюминия—8,05%. Содержание железа в отдельных группах пород колеблется очень резко: глинистые породы содержат значительно больше железа (5,5—8,Б"'»), чем пески (~1%): очень мало железа в известняках (0,5%). В природных водах концентрация железа и алюминия настолько незначительна, что их принято относить к числу микрокомпонентов.
Валентность железа различная, в водах оно присутствует в виде закисного (Fe++) и окисного (Fe+++), состояния. Двухвалентноt железо мигрирует в кислых (рН<5,5), слабее - в нейтральных и слабо — в щелочных водах.
При наличии свободного кислорода закисное железо неустойчиво и легко переходит в окисное, характеризующееся меньшей миграционной способностью. Реакция Fe++↔ Fe 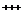 широко распространена в природе и имеет огромное гидрогеохимическое значение. Процесс окисления Fe++ во многих случаях протекает при участии микроорганизмов, называемых железобактериями. Образующийся при окислении Fe(ОН)3, очень мало растворим (при рН=4 около 0,05 мг/л, а при высоких рН — в тысячных и еще меньших долях мг/л), но может присутствовать в растворе в коллоидном состоянии. Для Fe+++ свойственна коллоидная миграция (с органическими соединениями). Коллоидное железо характерно для поверхностных вод (коллоиды Fe(ОН)3). По миграционным способностям Fe+++ аналогичен А1+++.
широко распространена в природе и имеет огромное гидрогеохимическое значение. Процесс окисления Fe++ во многих случаях протекает при участии микроорганизмов, называемых железобактериями. Образующийся при окислении Fe(ОН)3, очень мало растворим (при рН=4 около 0,05 мг/л, а при высоких рН — в тысячных и еще меньших долях мг/л), но может присутствовать в растворе в коллоидном состоянии. Для Fe+++ свойственна коллоидная миграция (с органическими соединениями). Коллоидное железо характерно для поверхностных вод (коллоиды Fe(ОН)3). По миграционным способностям Fe+++ аналогичен А1+++.
Закисное железо более типично для подземных вод, содержание его в них может доходить до 1 мг/л. Однако известны воды, в которых количество закисного железа доходит до нескольких десятков и сотен мг/л. Это воды кислые с рН<4, образующиеся преимущественно путем окисления сульфидов железа.
Источниками железа сложат самые различные горные породы, в которых железо распространено очень широко, хотя иногда и в малых количествах. Переход железа из пород в воду осуществляется либо под влиянием окислителей (кислород и др.), либо при действии кислот — органических, угольной и т. д.
Отличительная черта алюминия — его постоянная валентность. Содержание алюминия в водах крайне мало. Природные соединения алюминия имеют очень низкую растворимость.
Алюминий может присутствовать в водах в ионной и коллоидной формах. Ионный алюминий становится неустойчивым уже при рН=4,1. Несколько более устойчивы коллоидные растворы алюминия (коллоиды А1(ОН)3). Содержание алюминия в водах выражается сотыми и тысячными долями миллиграмма на литр, достигая десятков долей миллиграмма на литр в сильно кислых водах. Источниками алюминия служат продукты выветривания различных алюмосиликатов.
Органическое вещество. Природные воды почти всегда содержат в себе то или иное количество органического вещества. Органические соединения, несмотря на разнообразие их форм, состоят в основном из углерода, кислорода и водорода, составляющих 98,5% их веса. Кроме того, в малых количествах в них присутствуют азот, фосфор, сера, калий, кальций и многие другие элементы.
Органическое вещество по своей природе может быть подразделено на входящее в состав живых организмов, населяющих воду, и на органическое вещество, являющееся продуктом жизнедеятельности и распада отмерших организмов. Следует различать еще биогенные вещества, к которым принадлежат вещества, в той или иной мере связанные своим происхождением с жизнедеятельностью водных организмов. К последним относятся соединения азота
(NН4+,NО2-,NО3-, РО4--- и другие.
С санитарно-гигиенической точки зрения присутствующие в водах органические вещества делят на две группы:
1. Продукты распада растительных и животных остатков, дающие начало главным образом различным органическим кислотам и другим сложным органическим соединениям (соединения эти не ядовиты и в гигиеническом отношении безвредный).
2. Продукты разложения разнообразных отходов, попадающих в воду вместе со сточными водами. Эти вещества являются благоприятной средой для развития некоторых болезнетворных микроорганизмов и поэтому в питьевых водах недопустимы. Косвенными показателями присутствия таких соединений служат азотистая и азотная кислоты, аммиак, сероводород и пр.
Химический состав органических веществ весьма сложен и зависит от их происхождения. Большая часть их находится в растворе в коллоидном состоянии, часть — в истинном растворе и часть — во взвешенном состоянии. Суммарное количество содержащегося в воде органического вещества определяют по разности между сухим остатком и потерей при прокаливании (с учетом изменения ионного состава воды). Наиболее же распространенным методом является метод характеристики содержания органического вещества по количеству кислорода, расходуемого на его окисление. Это — так называемая величина окисляемости воды.
Для более точной оценки количества органического вещества в воде определяют суммарное содержание в ней органического углерода. Среди природных вод более высокой величиной окисляемости отличаются поверхностные воды по сравнению с подземными". Чистые горные реки и озера имеют окисляемость в 2—3 мг О2 на литр. Реки равнинные — 5—12, реки с болотным питанием — десятки мг О2 на литр. Окисляемость в подземных водах измеряется десятыми и сотыми долями миллиграммов О2 на литр. Исключение представляют воды нефтяных месторождений, для которых характерна сравнительно высокая окисляемость, достигающая десятков и сотен миллиграммов О2 на литр воды. Довольно высокую окисляемость имеют также грунтовые воды, загрязненные сточными водами или питающиеся за счет болот (десятки мг О2 на литр).
Можно назвать два источника обогащения подземных вод органическим веществом. 1) органическое вещество, привносимое сверху поверхностными водами; 2) органическое вещество, заключенное в породах водоносных горизонтов.
Поверхностные воды, инфильтруясь через почвенный покров, вымывают из него часть гумусовых веществ и других промежуточных продуктов распада и гумификации. Особенно легко это протекает в тех почвах, поглощенный комплекс которых насыщен водородом (кислые почвы), поэтому грунтовые воды, залегающие под такими почвами, содержат много органического вещества. Вообще концентрация органического вещества в водах верхнего водоносного горизонта определяется величиной содержания его в почвах и зоне аэрации.
Захваченное сверху инфильтрующимися водами органическое вещество по мере погружения вод в недра земли постепенно расходуется на окислительные и другие процессы. Поэтому воды нижних горизонтов артезианских бассейнов обычно содержат меньше органического вещества, чем воды горизонтов лежащих выше. Однако такое распределение органического вещества в водах артезианских бассейнов может бьггь нарушено, если в нижних водоносных горизонтах имеются собственные местные источники органического вещества. К категории пород, богатых органическим веществом, относятся битуминозные известняки и сланцы, угленосные породы и пласты угля, а также нефтеносные отложения. Подземные воды, связанные с такими породами и отложениями, будут выделяться высокой насыщенностью органическим веществом.
Основная литература: ОЛ 1 [38], 3 [27-44].
Дополнительная литература: ДЛ 1 [28 – 32].
Контрольные вопросы:
1. Какие подземные воды обогащаются органическими веществами?
2. Какие ионы определяют химический тип воды?
3. Какие отличительные особенности алюминия от железо?
4. Какая классификация предложена для систематизации рассолов соленых озер?
 2018-02-14
2018-02-14 3734
3734








