Термодинамические свойства растворов описываются общими для многокомпонентных систем соотношениями термодинамики. Число веществ n, количества которых в состоянии полного термодинамического равновесия могут быть заданы произвольно, называются числом независимых компонент раствора. Если число молекул (атомов) одной из компонент системы N намного превышает числа N 1, ..., N n-1 молекул остальных компонент, раствор называется разбавленным (слабым). Вещество, содержащее N частиц, в этом случае наз. растворителем, остальные компоненты - растворёнными веществами.
Диаграммы плавления и кипения растворов. В отличие от чистых веществ, изменение агрегатного состояния Р. происходит в нек-ром интервале изменения концентраций компонент, темп-ры и(или) давления. Простейший случай равновесия двух фаз реализуется, когда обе компоненты, образующие Р., в обеих фазах смешиваются в произвольных отношениях. Кривые равновесия в этом случае не имеют максимумов и минимумов и образуют характерную "сигару" (диаграмма Т - с, с - концентрация; рис. 1). Пусть для определённости рассматриваемые фазы представляют собой жидкость (низкотемпературная фаза II) и пар (высокотемпературная фаза I). Если изображающая точка системы (Т, с)лежит выше кривой FAG, то агрегатное состояние системы - пар, если ниже кривой FCG - жидкость. Заштрихованная область между кривыми FAG и FCG соответствует равновесию двух фаз (представляющих собой т. н. насыщенные растворы),

концентрации к-рых характеризуются растворимостью веществ и равны с' и с'', в точке В массы определяются "правилом рычага", согласно к-рому кол-ва молекул в фазах I и II обратно пропорциональны длине отрезков соответственно АВ и ВС:

В случае равновесия системы жидкость - пар кривая FAG наз. кривой конденсации, a FCG - кривой кипения. В случае равновесия твёрдой и жидкой фаз кривая FAG наз. кривой ликвидуса, a FCG - кривой солидуса.
Плавление это переход вещества из твердого кристаллического состояния в жидкое при нагревании. Плавление является фазовым переходом первого рода, который происходит с поглощением теплоты. Главными характеристиками такого перехода чистых веществ являются температура и энтальпия плавления. Если состав плавящегося вещества не изменяется, плавление называется конгруэнтным, если изменяется - ин конгруэнтным.
Плавлению предшествуют интенсивное разупорядочивание кристаллов вещества и проявление жидких микроучастков на поверхности кристаллов и вблизи межкристаллитных границ. По мере нагревания микроучастки укрупняются и сливаются, формируя жидкую фазу, а кристаллы рассыпаются на фрагменты и уменьшаются в размерах до полного исчезновения. Теплота, подводимая к веществу при плавлении, расходуется в основном на разрыв межатомных связей, а не на его нагревание. Поэтому чистые крупнокристаллические вещества в течение плавления не изменяют свою температуру (рис. 1). Для таких веществ температура плавления служит идентифицирующей характеристикой и критерием их чистоты. Плавление веществ со сходной кристаллической структурой описывается эмпирически формулой Линдемана:
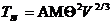 ,
,
где Тпл - температура плавления; А - постоянная для группы веществ; M и V – молекулярная масса и объем веществ; q -температура Дебая.
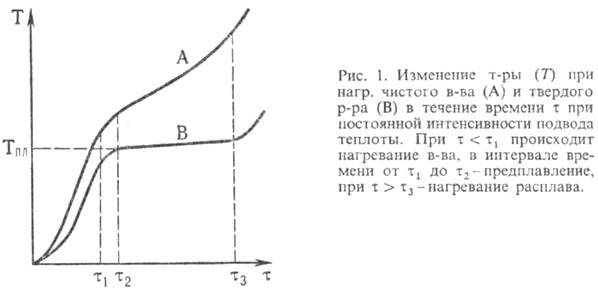
Температура плавления большинства чистых веществ (за исключением так называемых аномальных - Bi, Ga, Sb, льда и др.) возрастает с увеличением давления. Для давлений, меньших 105 Па, зависимость Тпл от давления p приближенно выражается эмпирической формулой Симона:
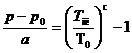 ,
,
где а и с - постоянные для данного вещества; p0 и T0 - координаты тройной точки.
 2018-02-20
2018-02-20 1499
1499







