Пример 1. Построить кривую титрования NaOH с=0.15моль/л раствором HCl с=0.3 моль/л и подобрать индикаторы.
Решение: NaOH – сильное основание, а HCl – сильная кислота, поэтому в данном случае рассмотрим титрование сильного основания сильной кислотой.
Предположим, что для титрования взяли 100,00 мл (V0) раствора NaOH с0=с(NaOH)=0.15 моль/л. По закону эквивалентов рассчитаем обьем раствора HCl (Vх), необходимый для оттитровывания NaOH(для достижения т.э.):
100,00∙ 0,15= Vх∙0,30; Vх=50,00 мл.
Для простоты расчета допустим, что обьем раствора при титровании не измениняется.
1. Сильные кислоты и основания в водном растворе диссоциированы нацело, поэтому концентрацию Н+ или рН рассчитывают исходя из концентрации NaOH по уравнению:
рН=14- рОН= 14+lg0,15=13,18.
2. Значения рН раствора до т.э. будут определяться концентрацией неоттитрованного основания. При прибавлении 25,00мл(50%) раствора HCl на титрование затрачено n(HCl)=25,00∙10-3∙ 0,30=7,50∙10-3моль.Неоттитрованное количество NaOH определяется вычитанием эквивалентного количества от исходного:
100,00∙10-3∙0,15-7,50∙10-3=7,50∙10-3 моль.
Отсюда с(NaOH)=7,50∙10-3/100,00∙10-3=7,50∙10-2моль/л, а
рН=14+lg(C0V0-CTVT)/V0,
где Ст и С0 – исходные концентрации растворов титранта и
титруемого вещества соответственно; V0—исходный обьем
титруемого вещества; VT—добавленный обьем титранта.
Таким же образом рассчитываем рН при прибавлении 45,00 мл
раствора HCl (45,00:50,00∙100=90%):
рН=14+lg(0,15∙100,00-0,30∙45,00)/100=12,18.
Если добавлено 49,50 мл раствора HCl (49,50:50,00∙100=99%),то
рН=14+lg(0,15∙100,00-0,30∙49,95)/100=11,18.
После прибавления 49,95 мл раствора HCl (49,95:50,00∙100=99,9%):
рН=14+(0,15∙100,00-0,30∙49,95)/100=10,18.
3. В точке эквивалентности рН определяется автопротолизом воды, рН=1/2рКв=7.
4. После точки эквивалентности рН определяется избытком HCl.
При добавлении 50,05 мл раствора HCl(50,05:50,00∙100=100,1%):
рН=-lg(СтVT—C0V0)/V0,
а так как в точке эквивалентности количество моль титруемого вещества равно количеству моль титранта, т.е. C0V0=100,00∙0,15=50,00∙0,30,то
рН=- lg(50,05-50,00)∙0,30/100,00=3,82.
При добавлении 50,50 мл раствора HCl(50,50:50,00∙100=101%)
рН= -lg(50,50-50,00)∙0,3/100,00=2,82.
При добавлении 55,00мл рствора HCl (55,00:50,00∙100=110%):
рН=-lg(55,00-50,00)∙0,30/100,00=1,82.
Результаты вычислений сведем в таблицу и по данным таблицы построим кривую титрования.

Кривая титрования 0,15моль/л раствора гидроксида натрия 0,30 моль/л раствором соляной кислоты (рис.1).
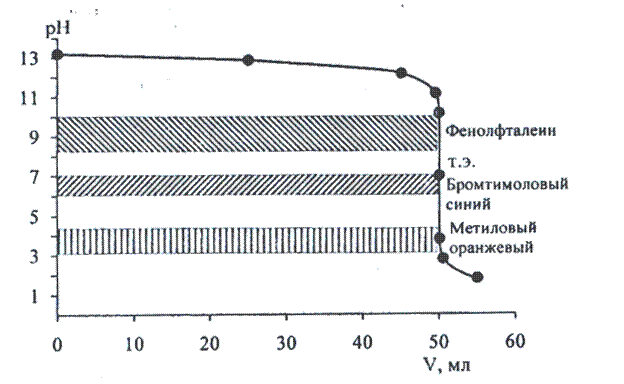
Скачок титрования определяется резким изменением рН от 10,18 до 3,82 при недотитровывании или перетитровывании на 0,1% соответственно. Правило выбора индикаторов предусматривает, что интервал перехода окраски индикатора должен укладываться в скачок титрования. Используя справочные данные по интервалу перехода окраски индикаторов, выбираем наиболее часто применяемые индикаторы: метиловый оранжевый (интервал перехода 3,1-4,4 рТ=4), фенолфталеин (интервал перехода 8,2-10,0 рТ=9,0), бромтимоловый синий (интервал перехода 6,0-7,6 рТ=7,0)
 2018-02-20
2018-02-20 486
486








