Введение
Полимеразная цепная реакция (ПЦР) была изобретена в 1983 году американским биохимиком КэриМуллисом. Его целью была амплификация (увеличение количества копий) участка ДНК. Первая публикация, описывающая применение ПЦР для амплификации гена бета-глобина и пренатальной диагностики серповидно-клеточной анемии была опубликована в 1985 году в журнале Science. И уже через 8 лет после этого за изобретение метода ПЦР К. Муллис получил Нобелевскую премию.
В начале использования метода после каждого цикла нагревания и последующего охлаждения в реакционную смесь добавлялиаликвотуфермента ДНК-полимеразы, так как она инактивировалась при высокой температуре, необходимой для плавления цепей ДНК. В связи с этим процедура проведения реакции была сравнительно неэффективной, требовала много времени и фермента.
 |
| Изобретатель ПЦР – КэриМуллис |
В 1986 году метод полимеразной цепной реакции был существенно улучшен: было предложено использовать ДНК-полимеразу из термофильных бактерий– организмов, живущих при относительно высоких температурах свыше 45 °C. Такие термостабильные ферменты способны выдерживать множество циклов нагревания в процессе полимеразной реакции.Их использование позволило упростить и автоматизировать проведение ПЦР. Одна из первых термостабильных ДНК-полимераз была выделена из бактерий Thermusaquaticus и названа Taq-полимеразой.Недостаток этого фермента заключается в том, что вероятность внесения ошибочного нуклеотида в цепь ДНК у неё достаточно высока, так как у этого фермента отсутствуют механизмы исправления ошибок (3'→5' экзонуклеазная активность). Полимеразы Pfu и Pwo, позднее были выделены из Архей и обладают таким механизмом исправления ошибок. Использование этих полимераз значительно уменьшает число мутаций в ДНК, однако их скорость амплификации ниже, чем у полимеразы Taq.
Репликация ДНК
Репликация ДНК– процесс синтеза дочерней молекулы дезоксирибонуклеиновой кислоты на матрице родительской молекулы ДНК. В ходе последующего деления материнской клетки каждая дочерняя клетка получает по одной копии молекулы ДНК, которая является идентичной ДНК исходной материнской клетки. Этот процесс обеспечивает точную передачу генетической информации из поколения в поколение. Репликацию ДНК осуществляет сложный ферментный комплекс, состоящий из более 20 различных белков.
Репликация начинается с расплетания двойной спирали ДНК, при этом формируется репликационная вилка — место непосредственной репликации ДНК. В репликационной вилке ДНК копирует крупный белковый комплекс, ключевым ферментом которого является ДНК-полимераза. Репликационная вилка движется со скоростью порядка 100 000 пар нуклеотидов в минуту у прокариот и 500–5000 у эукариот.
Ферменты (хеликаза, топоизомераза) и ДНК-связывающие белки расплетают ДНК, удерживают матрицу в разведённом состоянии и вращают молекулу ДНК. Правильность репликации обеспечивается точным соответствием комплементарных пар оснований и активностью ДНК-полимеразы, способной распознать и исправить ошибку.
Цепи молекулы ДНК расходятся, образуют репликационную вилку, и каждая из них становится матрицей, на которой синтезируется новая комплементарная цепь. В результате образуются две новые двуспиральные молекулы ДНК, идентичные родительской молекуле.
Принципы репликации
· матричный — последовательность синтезируемой цепи ДНК однозначно определяется последовательностью материнской цепи в соответствии с принципом комплементарности;
· полуконсервативный — одна цепь молекулы ДНК, образовавшейся в результате репликации, является вновь синтезированной, а вторая — материнской;
· идёт в направлении от 5’-конца новой молекулы к 3’-концу;
· необходимость в затравке (праймере).
ДНК-полимераза
ДНК-полимераза – основной фермент репликации ДНК. В обычной ПЦР применяют ДНК-зависимую ДНК-полимеразу (КФ 2.7.7.7), которая использует в качестве матрицы одну из цепей ДНК. Для анализа РНК в ПЦР с обратной транскрипцией используют РНК-зависимую ДНК-полимеразу (обратную транскриптазу, КФ 2.7.7.49).
Для нормального функционирования ДНК-полимеразе требуется присутствие ионов магния в качестве кофактора. В отсутствие ионов магния ДНК-полимераза неактивна. ДНК-полимераза начинает репликацию ДНК, связываясь с двуцепочечным участком ДНК (затравкой, праймером) и присоединяет нуклеотиды в направлении 5’→3’. В качестве субстрата ДНК-полимераза использует нуклеозидтрифосфаты (дАТР, дАТР, дЦТР, дГТФ).
Амплификатор
Амплификатор (термоциклер, ПЦР-машина) – прибор, обеспечивающий периодическое охлаждение и нагревание пробирок, обычно с точностью не менее 0,1° C. Современные амплификаторы позволяют задавать нужное количество циклов и выбирать оптимальные временные и температурные параметры для каждой процедуры цикла.
Прибор производит определенное количество попеременных нагревов и охлаждений (термоциклов) в зависимости от используемого метода и повторяет их множество раз. Для получения лучшего результата изменения температурных уровней должны совершаться в течение минимального промежутка времени. С помощью амплификатора температура цикла может быть достигнута
 |
| Термоциклер |
за считанные секунды, даже начиная с удаленных значений последней установленной точки. Данные изменения происходят с поддержанием идеальной однородности между различными точками блока. Систему также можно запрограммировать так, чтобы создать условия линейно и градиентно изменяющейся температуры по ширине блока. Таким образом достигается определение и оптимизация точек с наивысшим уровнем производительности.
Амплификатор ДНК состоит из внутренней системы крышки с нагревательным элементом и регулировкой высоты для того, чтобы адаптировать прибор к размерам пробирок с образцом. Таким образом, предотвращается конденсация в верхней части образцов. Прибор работает на основе системы нагревания, получающей непрерывное питание от источника электрического тока и состоящей из нескольких термоэлектрических модулей с эффектом Пельтье, радиатором с низкими теплопотерями и системой вентиляторного конвектора. Все элементы амплификатора составляют один блок. Благодаря этому система позволяет увеличивать производительность процесса, а также быстро определять и изменять температуру блока, переходя от высшего предела температуры к низшему в течение минимального времени.
|
| Этап 1 – денатурация. 1 минута, 94 С. |
| Этап 2 – отжиг. 45 секунд, 54 С. | |
| Этап 3 – элонгация. 2 минуты, 72 С. | |
| Стадии ПЦР | |
Стадии ПЦР
Метод ПЦР основан на многократном избирательном копировании определённого участка при помощи ферментов invitro (в пробирке). При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце. В отличие от репликации ДНК в живых организмах, с помощью ПЦР амплифицируются относительно короткие участки ДНК, в обычной реакции длина копируемых ДНК-участков составляет не более 3000 пар оснований. Однако, использование смесей различных полимераз, а также специальных ДНК-полимераз, позволяет при определённых условиях копировать участки длиной до 40 тысяч пар нуклеотидов. Обычно при проведении ПЦР выполняют 20-35 циклов, каждый из которых состоит из трёх стадий: денатурации матрицы, отжига праймеров и элонгации.
Реакционная смесь для проведения ПЦР состоит из матрицы – ДНК, участок которой необходимо амплифицировать, пары праймеров – олигонуклеотидов длиной около 20 оснований, комплементарных целевой последовательности ДНК, фермента ДНК-полимеразы, дезоксинуклеозидтрифосфатов и хлорида магния, буферного раствора (поддерживает рН реакционной смеси на постоянном уровне). Чтобы избежать испарения реакционной смеси, в пробирку добавляют минеральное масло, если используется амплификатор с подогревающейся крышкой, этоне требуется.
Денатурация
Реакционную смесь нагревают до 94–96 °C на 0,5-2 минуты, чтобы цепи ДНК денатурировали. При этом происходит разрушение водородных связей между азотистыми основаниями цепей ДНК. Обычно, перед первым циклом проводят длительный прогрев реакционной смеси в течение 2–5 мин для полной денатурации геномной ДНК.
Отжиг
После плавления матрицы ДНК температуру понижают, чтобы праймеры могли связаться с одноцепочечной матрицей. Температура отжига зависит от состава праймеров и обычно выбирается на 5 градусов меньше, чем температура плавления (диссоциации) праймеров. Неправильный выбор температуры отжига приводит либо к плохому связыванию праймеров с матрицей (при завышенной температуре), либо к связыванию в неверном месте и появлению неспецифических продуктов (при заниженной температуре). Время стадии отжига порядка 30 сек, за это время полимераза способна синтезировать несколько сотен нуклеотидов, поэтому рекомендуют подбирать праймеры с температурой плавления выше 60 °C и проводить отжиг и элонгацию одновременно, при 60–72 °C.
Элонгация
ДНК-полимераза присоединяет нуклеотиды только к существующим молекулам ДНК, поэтому для репликации матричной цепи ДНК требуется праймер (затравка) – короткий одноцепочечный фрагмент ДНК, комплементарный заданному участку.
На стадии элонгации ДНК-полимераза начинает синтез второй цепи от 3'-конца праймера, который связался с матрицей. Температура, оптимальная для элонгации, зависит от полимеразы: часто используемые полимеразы Taq и Pfu наиболее активны при 72 ° C. Время элонгации зависит как от типа ДНК-полимеразы, так и от длины амплифицируемого фрагмента. Обычно время элонгации принимают равным одной минуте на каждую тысячу пар оснований. После окончания всех циклов часто проводят дополнительную стадию финальной элонгации, чтобы достроить все одноцепочечные фрагменты. Эта стадия длится 7–10 минут.
 |
| Амплификация фрагмента ДНК в процессе ПЦР |
Количество специфического продукта реакции, ограниченного праймерами, возрастает пропорционально 2n, где n – число циклов реакции. На самом деле эффективность каждого цикла как правило меньше 100 %, поэтому в действительности количество продукта пропорционально (1+E)n,где Е – средняя эффективность цикла. Число протяженных копий ДНК, ограниченных одним праймером, растет линейно, поэтому в продуктах реакции доминирует специфический фрагмент. Амплификация целевого продукта в геометрической прогрессии ограничена количеством реагентов, присутствием ингибиторов (веществ, которые подавляют или тормозят реакцию), образованием побочных продуктов. На последних циклах реакции рост замедляется, это называют «эффектом плато».
Применение ПЦР
ПЦР используют в медицине для диагностики, в научно-исследовательских лабораториях.
Диагностика
ПЦР дает возможность существенно ускорить и облегчить диагностику инфекционных (вирусных, бактериальных) и наследственных заболеваний. Из крови пациента выделяют препарат ДНК, заданный ген амплифицируют с помощью ПЦР с использованием соответствующих специфических праймеров, а затем проводят секвенирование (определение их или нуклеотидной последовательности)амплифицированного участка и анализируют его. Вирусные и другие инфекционные заболевания при помощи ПЦР можно диагностировать практически сразу после заражения, за недели или месяцы до того, как проявятся симптомы заболевания, по появлению продуктов реакции амплификации (присутствия ДНК инфекционного агента).
Важную роль играет ПЦР и в персонализованной медицине: иногда лекарства оказываются токсичными или аллергенными для некоторых пациентов, причиной этого является различие в восприимчивости и метаболизме лекарств. Эти различия определены на генетическом уровне, например, цитохромыпечени разных пациентов могут отличатьсяактивностью в отношении определенных субстратов. Для того, чтобы определить, какой разновидностью цитохрома обладает данный пациент, перед применением лекарства может быть проведено предварительное генотипирование и разработана индивидуальная схема лечения.
Генотипирование, секвенирование
Клонирование генов – это процесс выделения гена и получения большого количества продукта данного гена. ПЦР используют в клонировании для амплификации участка ДНК, который в дальнейшем встраивают вдругой фрагмент ДНК (вектор), переносящий чужеродный ген в другой организм. В качестве векторов используют, например, плазмиды (кольцевые молекулы ДНК) или вирусы. При помощи клонирования генов в биотехнологии получают многие белки, например, инсулин, интерфероны.
В методе секвенирования поСэнгеру с использованием меченых флуоресцентной меткой или радиоактивным изотопом дидезоксинуклеотидтрифосфатов,ПЦР является неотъемлемой частью, так как именно в ходе полимеризации в цепь ДНК встраиваются производные нуклеотидов, меченные флуоресцентной или радиоактивной меткой. Присоединение дидезоксинуклеотида к синтезируемой цепи приводит к обрыву синтеза, позволяя определить положение специфических нуклеотидов после разделения в полиакриламидном геле или при помощи капиллярного электрофореза.
Криминалистика
ПЦР используют для сравнения так называемых «генетических отпечатков пальцев». Для этого необходим образец генетического материала с места преступления – кровь, слюна, сперма, волосы: из образца выделяют ДНК и сравнивают с генетическим материалом подозреваемого. Достоинством метода является то, что для анализа требуется совсем малое количество ДНК. Продукты амплификации расщепляют на фрагменты, и разделяют с помощью агарозного электрофореза. Полученную картину расположения полос ДНК и называют «генетическим отпечатком».
 |
| Кофеин –1,3,7-триметил-ксантин. |
Установление отцовства. Хотя «генетические отпечатки» уникальны, за исключением однояйцевых близнецов, родственные связи все же можно установить, сделав несколько таких отпечатков. Комбинации отпечатков позволяют судить о том, являются доноры ДНК родственниками, или нет.
Кофеин
Кофеин – алкалоид пуринового ряда. Он содержится в листьях и плодах растений: кофейное дерево, чай, какао, мате, гуарана, кола и другие. Кофеин синтезируется растениями для защиты от насекомых, поедающих листья, стебли и зёрна, а также для поощрения опылителей. Он является психостимулятором, содержится в кофе, чае.
 |
| Пурин |
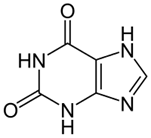 |
| Ксантин |
Кофеин стимулирует центральную нервную систему человека, усиливает сердечную деятельность, ускоряет пульс, вызывает расширение кровеносных сосудов, обладает мочегонным эффектом, снижает агрегацию тромбоцитов.
Биологическая активность кофеина связана с тем, что кофеин блокирует фермент фосфодиэстеразу, разрушающий цАМФ, что приводит к его накоплению в клетках. цАМФ–вторичный посредник, через который осуществляются эффекты различных физиологически активных веществ, прежде всего, адреналина. Таким образом, накопление цАМФ приводит к адреналино-подобным эффектам.
В медицине кофеин применяют в составе средств от головной боли, при мигрени, как стимулятор дыхания и сердечной деятельности при простудных заболеваниях, для повышения умственной и физической работоспособности, для устранения сонливости.
История изучения
Кофеин был открыт в 1819 году немецким химиком Фердинандом Рунге. В 1827 году Удри выделил из чайных листьев новый алкалоид и назвал его теином.
В чистом виде кофеин впервые получен в 1828 году Пьером Ж Пеллетье и Жозефом Б. Кавантом. В 1838 году Иобст и Мульдер доказали, что теин и кофеин – одно и то же вещество.
Структура кофеина была установлена в конце XIX века Фишером. Он впервые искусственно синтезировал кофеин.
Химически чистый кофеин — это белые игольчатые кристаллы горьковатого вкуса, без запаха. Кофеин плохо растворим в холодной воде (1 г на 46 мл воды), легко — в горячей (1 г на 5,5 мл воды при 80 С; 1 г на 1,5 мл кипящей воды). Также 1 г кофеина растворим в 66 мл этанола; в 22 мл этанола при 60 С; в 50 мл ацетона; в 5,5 мл хлороформа; в 530 мл эфира; в 100 мл бензола; в 22 мл кипящего бензола.
Растворы кофеина имеют нейтральную реакцию.
 2018-02-20
2018-02-20 2557
2557








