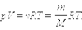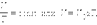Соотношение
| p = nkT, |
связывающее давление газа с его температурой и концентрацией молекул, получено в §3.2 для модели идеального газа, молекулы которого взаимодействуют между собой и со стенками сосуда только во время упругих столкновений. Это соотношение может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа – объемом V, давлением p, температурой T и количеством вещества ν. Для этого нужно использовать равенства
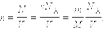
|
Здесь N – число молекул в сосуде, N А – постоянная Авогадро, m – масса газа в сосуде, M – молярная масса газа. В итоге получим:
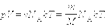
|
Произведение постоянной Авогадро N А на постоянную Больцмана k называется универсальной газовой постоянной и обозначается буквой R. Ее численное значение в СИ есть:
| R = 8,31 Дж/моль·К. |
Соотношение
| (*) |
называется уравнением состояния идеального газа.
Для одного моля любого газа это соотношение принимает вид:
|
Если температура газа равна T н = 273,15 К (0 °С), а давление p н = 1 атм = 1,013·105 Па, то говорят, что газ находится при нормальных условиях. Как следует из уравнения состояния идеального газа, один моль любого газа при нормальных условиях занимает один и тот же объем V 0, равный
| V 0 = 0,0224 м3/моль = 22,4 дм3/моль. |
Это утверждение называется законом Авогадро.
Для смеси невзаимодействующих газов уравнение состояния принимает вид
|
где ν1, ν2, ν3 и т. д. – количество вещества каждого из газов в смеси.
Уравнение, устанавливающее связь между давлением, объемом и температурой газа было получено в середине XIX века французским физиком Б. Клапейроном, в форме (*) оно было впервые записано Д. И. Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона–Менделеева.
Следует отметить, что задолго до того, как уравнение состояния идеального газа было теоретически получено на основе молекулярно-кинетической модели, закономерности поведения газов в различных условиях были хорошо изучены экспериментально. Поэтому уравнение (*) можно рассматривать как обобщение опытных фактов, которые находят объяснение в молекулярно-кинетической теории.
Газ может участвовать в различных тепловых процессах, при которых могут изменяться все параметры, описывающие его состояние (p, V и T). Если процесс протекает достаточно медленно, то в любой момент система близка к своему равновесному состоянию. Такие процессы называются квазистатическими. В привычном для нас масштабе времени эти процессы могут протекать и не очень медленно. Например, разрежения и сжатия газа в звуковой волне, происходящие сотни раз в секунду, можно рассматривать как квазистатический процесс. Квазистатические процессы могут быть изображены на диаграмме состояний (например, в координатах p, V) в виде некоторой траектории, каждая точка которой представляет равновесное состояние.
Интерес представляют процессы, в которых один из параметров (p, V или T) остается неизменным. Такие процессы называются изопроцессами.
Изотермический процесс (T = const)
Изотермическим процессом называют квазистатический процесс, протекающий при постоянной температуре T. Из уравнения (*) состояния идеального газа следует, что при постоянной температуре T и неизменном количестве вещества ν в сосуде произведение давления p газа на его объем V должно оставаться постоянным:
|
 На плоскости (p, V) изотермические процессы изображаются при различных значениях температуры T семейством гипербол p ~ 1 / V, которые называются изотермами. Так как коэффициент пропорциональности в этом соотношении увеличивается с ростом температуры, изотермы, соответствующие более высоким значениям температуры, располагаются на графике выше изотерм, соответствующих меньшим значениям температуры (рис. 3.3.1). Уравнение изотермического процесса было получено из эксперимента английским физиком Р. Бойлем (1662 г.) и независимо французским физиком Э. Мариоттом (1676 г.). Поэтому это уравнение называют законом Бойля–Мариотта.
На плоскости (p, V) изотермические процессы изображаются при различных значениях температуры T семейством гипербол p ~ 1 / V, которые называются изотермами. Так как коэффициент пропорциональности в этом соотношении увеличивается с ростом температуры, изотермы, соответствующие более высоким значениям температуры, располагаются на графике выше изотерм, соответствующих меньшим значениям температуры (рис. 3.3.1). Уравнение изотермического процесса было получено из эксперимента английским физиком Р. Бойлем (1662 г.) и независимо французским физиком Э. Мариоттом (1676 г.). Поэтому это уравнение называют законом Бойля–Мариотта.
Изохорный процесс (V = const)
Изохорный процесс – это процесс квазистатического нагревания или охлаждения газа при постоянном объеме V и при условии, что количество вещества ν в сосуде остается неизменным.
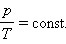 Как следует из уравнения (*) состояния идеального газа, при этих условиях давление газа p изменяется прямо пропорционально его абсолютной температуре: p ~ T или
Как следует из уравнения (*) состояния идеального газа, при этих условиях давление газа p изменяется прямо пропорционально его абсолютной температуре: p ~ T или
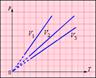 На плоскости (p, T) изохорные процессы для заданного количества вещества ν при различных значениях объема V изображаются семейством прямых линий, которые называются изохорами. Большим значениям объема соответствуют изохоры с меньшим наклоном по отношению к оси температур (рис. 3.3.2).
На плоскости (p, T) изохорные процессы для заданного количества вещества ν при различных значениях объема V изображаются семейством прямых линий, которые называются изохорами. Большим значениям объема соответствуют изохоры с меньшим наклоном по отношению к оси температур (рис. 3.3.2).
Экспериментально зависимость давления газа от температуры исследовал французский физик Ж. Шарль (1787 г.). Поэтому уравнение изохорного процесса называется законом Шарля.
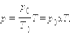 Уравнение изохорного процесса может быть записано в виде:
Уравнение изохорного процесса может быть записано в виде:
где p 0 – давление газа при T = T 0 = 273,15 К (т. е. при температуре 0 °С). Коэффициент α, равный (1/273,15) К–1, называют температурным коэффициентом давления.
Изобарный процесс (p = const)
Изобарным процессом называют квазистатический процесс, протекающий при неизменным давлении p.
Уравнение изобарного процесса для некоторого неизменного количества вещества ν имеет вид:
|
где V 0 – объем газа при температуре 0 °С. Коэффициент α равен (1/273,15) К–1. Его называют температурным коэффициентом объемного расширения газов.
 На плоскости (V, T) изобарные процессы при разных значениях давления p изображаются семейством прямых линий (рис. 3.3.3), которые называются изобарами.
На плоскости (V, T) изобарные процессы при разных значениях давления p изображаются семейством прямых линий (рис. 3.3.3), которые называются изобарами.
Зависимость объема газа от температуры при неизменном давлении была экспериментально исследована французским физиком Ж. Гей-Люссаком (1862 г.). Поэтому уравнение изобарного процесса называют законом Гей-Люссака.
Экспериментально установленные законы Бойля–Мариотта, Шарля и Гей-Люссака находят объяснение в молекулярно-кинетической теории газов. Они являются следствием уравнения состояния идеального газа.
20. Первое начало термодинамики. Внутренняя энергия системы. Работа, совершаемая телом при расширении. Изображение работы процесса и цикла в координатах (p, V).
Первое начало термодинамики устанавливает соотношение между теплотой Q, работой А и изменением внутренней энергии системы ΔU.
Q=∆U+A, где A – работа газа
Количество теплоты, сообщенное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Для малых (элементарных) процессов: dQ = dU+dA
Внутренняя энергия – это функция состояния.
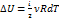 , где
, где 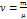 ; i – эточисло степеней свободы
; i – эточисло степеней свободы
Работа газа при расширении:
dA = pdV
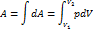
Если p=const Þ 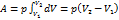 Þ A = p∆V
Þ A = p∆V
Работа совершается только в том случае, если объем изменяется.
Изображение работы в координатах p, V
Работа цикла:
Работа процесса:
21. Применение первого начала термодинамики к изопроцессам и адиабатическому процессу (T=const, P=const, V=const, Q=0).
1) V = const (изохорный процесс)
dA = 0 Þ 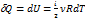
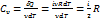 Þ dQ = CvνdT
Þ dQ = CvνdT
где Сv – это молярная теплоемкость при V = const [ 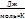 ]
]
2) p = const (изобарный процесс)
dQ = dU + dA
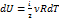
dA = pdV = νRdT
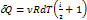
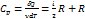 Þ Cp = Cv +R
Þ Cp = Cv +R
где Сp – это молярная теплоемкость при р = const
3) T = const (изотермический процесс)
dU = 0
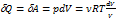
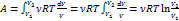
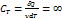 , dT = 0
, dT = 0
4) Q=0 (адиабатический процесс – это процесс, проходящий без теплообмена с окружающей средой)
dQ = 0
dA = −dU
В этом случае работа совершается засчет внутренней энергии.
22. Понятие адиабатического процесса. Связь между параметрами идеального газа при адиабатическом процессе. Уравнение Пуассона.
Адиабатический процесс – это процесс, проходящий без теплообмена с окружающей средой
dQ = 0
dA = −dU
В этом случае работа совершается засчет внутренней энергии.
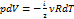
pdV = −Cvν dT
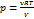 Þ
Þ 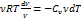
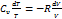
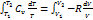
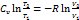
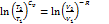 Þ
Þ 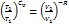
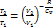 , Cp = CV + R, −R =CV –Cp Þ
, Cp = CV + R, −R =CV –Cp Þ 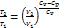
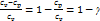 Þ
Þ 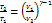 Þ
Þ 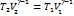
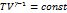
PV = νRT
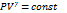 − уравнение Пуассона
− уравнение Пуассона
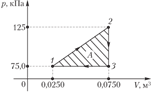
23. Если известна для некоторого обратимого процесса зависимость давления газа от объема, т. е. функция p=f(V), то работа, совершаемая в ходе этого процесса, вычисляется путем интегрирования: 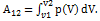
где V1 и V2 – объем газа в начальном и конечном состояниях.
1. m=const; V=const; - изохорный процесс. d¢А=p(V)dV=0; 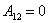
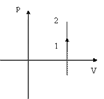 В ходе изохорного (изохорического) процесса работа равна 0,это справедливо не только для идеального газа, но и вообще для всякого тела, т.к. приращение объёма dV=0.
В ходе изохорного (изохорического) процесса работа равна 0,это справедливо не только для идеального газа, но и вообще для всякого тела, т.к. приращение объёма dV=0.
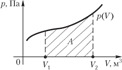
2. m=const; P=const - изобарный процесс.
Тогда при интегрировании постоянное давление можно вынести из-под знака интеграла:
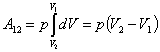
|
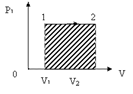 Эта формула справедлива для любого тела. Если известен график зависимости Р=f(V), то величину работы в изобарном процессе можно найти графически, она численно равна площади заштрихованного прямоугольника
Эта формула справедлива для любого тела. Если известен график зависимости Р=f(V), то величину работы в изобарном процессе можно найти графически, она численно равна площади заштрихованного прямоугольника

3. T=const. Изотермический процесс.
Но из уравнения Менделеева – Клапейрона следует: 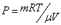
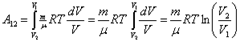
но 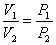 из закона Бойля – Мариотта, тогда
из закона Бойля – Мариотта, тогда
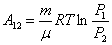 ИЛИ ИЛИ 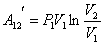
|
 Адиабатный процесс.
Адиабатный процесс. 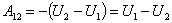
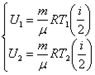 Работа в адиабатном процессе совершается за счёт убыли внутренней энергии идеального газа.
Работа в адиабатном процессе совершается за счёт убыли внутренней энергии идеального газа.
Запишем выражения для внутренней энергии идеального газа для состояний 1 и 2
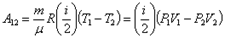 Подставив значения внутренней энергии для состояний 1 и 2 в соотношение получим формулу для расчёта работы в адиабатном процессе:
Подставив значения внутренней энергии для состояний 1 и 2 в соотношение получим формулу для расчёта работы в адиабатном процессе:
Используя формулу связи между числом степеней свободы и показателем адиабаты для идеального газа преобразуем формулу для расчёта работы газа в адиабатном процессе таким образом:
Т.к. 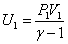 ;
; 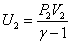 ; U2=(P2 V2)/(g-1), тогда
; U2=(P2 V2)/(g-1), тогда
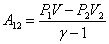 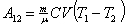
|
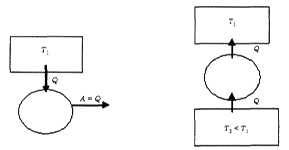
24. 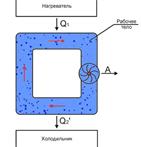 Тепловые машины предназначены для получения полезной работы за счет теплоты, выделяемой вследствие химических реакций (сгорание топлива), ядерных превращений или по другим причинам. Для функционирования тепловой машины обязательно необходимы следующие составляющие: нагреватель, холодильник и рабочее тело.
Тепловые машины предназначены для получения полезной работы за счет теплоты, выделяемой вследствие химических реакций (сгорание топлива), ядерных превращений или по другим причинам. Для функционирования тепловой машины обязательно необходимы следующие составляющие: нагреватель, холодильник и рабочее тело.
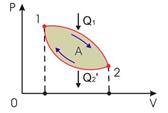 Принцип действия тепловых машин: Нагреватель передает рабочему телу теплоту
Принцип действия тепловых машин: Нагреватель передает рабочему телу теплоту 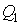 , вызывая повышение его температуры. Рабочее тело совершает работу
, вызывая повышение его температуры. Рабочее тело совершает работу 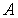 над каким-либо механическим устройством, например, приводит во вращение турбину, и далее отдает холодильнику теплоту
над каким-либо механическим устройством, например, приводит во вращение турбину, и далее отдает холодильнику теплоту 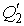 , возвращаясь в исходное состояние. Величина
, возвращаясь в исходное состояние. Величина 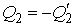 представляет собой количество теплоты, передаваемое холодильником рабочему телу, и имеет отрицательное значение.
представляет собой количество теплоты, передаваемое холодильником рабочему телу, и имеет отрицательное значение.
Отметим, что наличие холодильника и передача ему части полученной от нагревателя теплоты, является обязательным, так как иначе работа тепловой машины невозможна. Действительно, для получения механической работы необходимо наличие потока, в данном случае потока теплоты. Если же холодильник будет отсутствовать, то рабочее тело неизбежно придет в тепловое равновесие с нагревателем, и поток теплоты прекратится.
В соответствии с первым началом термодинамики при осуществлении кругового процесса, из-за возвращения рабочего тела в исходное состояние, его внутренняя энергия за цикл не изменяется. Поэтому совершенная рабочим телом механическая работа равна разности подведенной и отведенной теплоты: 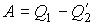
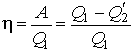 Тепловой коэффициент полезного действия (к.п.д.) цикла любой тепловой машины можно рассчитать как отношение полезной работы
Тепловой коэффициент полезного действия (к.п.д.) цикла любой тепловой машины можно рассчитать как отношение полезной работы 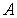 к количеству теплоты
к количеству теплоты 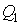 , переданной от нагревателя:
, переданной от нагревателя:
Из выражения следует, что к.п.д. любой тепловой машины всегда меньше единицы, так как часть полученной от нагревателя теплоты должна передаваться холодильнику.
 Согласно Клаузиусу, невозможен процесс, единственным результатом которого был бы переход теплоты от тела с более низкой температурой к телу с более высокой температурой.
Согласно Клаузиусу, невозможен процесс, единственным результатом которого был бы переход теплоты от тела с более низкой температурой к телу с более высокой температурой.
Томсон сформулировал второй закон термодинамики следующим образом: невозможен периодический процесс, единственным конечным результатом которого было бы совершение работы за счет теплоты, взятой от одного какого-то тела.
С помощью понятия энтропии стало возможным сформулировать второй закон термодинамики математически. Второй закон термодинамики - это закон возрастания энтропии для замкнутых систем или неравенство Клаузиуса:
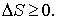
При всех процессах в макроскопической системе энтропия системы возрастает (необратимые процессы) или остается неизменной (обратимые процессы).
Если система по какому-либо параметру выведена из состояния равновесия, то наиболее вероятным является процесс возвращения системы в положение равновесия.
Второе начало термодинамики применимо только к макроскопическим системам, состоящим из огромного числа молекул, это статистический закон.
25. 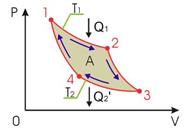 25. Обратимый цикл Карно состоит из двух изотерм, описывающих процесс теплопередачи от нагревателя к рабочему телу и от рабочего тела к холодильнику, и двух адиабат, описывающих расширение и сжатие рабочего тела в тепловой машине. Температура нагревателя считается равной
25. Обратимый цикл Карно состоит из двух изотерм, описывающих процесс теплопередачи от нагревателя к рабочему телу и от рабочего тела к холодильнику, и двух адиабат, описывающих расширение и сжатие рабочего тела в тепловой машине. Температура нагревателя считается равной 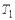 , а температура холодильника - соответственно
, а температура холодильника - соответственно 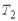 . При этом температуры нагревателя
. При этом температуры нагревателя 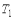 и холодильника
и холодильника 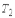 постоянны, что должно обеспечиваться бесконечно большой теплоемкостью используемых тепловых резервуаров.
постоянны, что должно обеспечиваться бесконечно большой теплоемкостью используемых тепловых резервуаров.
При первом изотермическом процессе 1-2 происходит передача рабочему телу теплоты 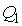 , причем эта теплота передается бесконечно медленно, при практически нулевой разнице температуры между нагревателем и рабочим телом. Далее рабочее тело подвергается адиабатическому расширению без теплообмена с окружающей средой (процесс 2-3). При последующем изотермическом процессе 3-4 холодильник забирает у рабочего тела теплоту
, причем эта теплота передается бесконечно медленно, при практически нулевой разнице температуры между нагревателем и рабочим телом. Далее рабочее тело подвергается адиабатическому расширению без теплообмена с окружающей средой (процесс 2-3). При последующем изотермическом процессе 3-4 холодильник забирает у рабочего тела теплоту 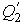 . Процесс 4-1 представляет собой адиабатическое сжатие, переводящее рабочее тело в первоначальное состояние.
. Процесс 4-1 представляет собой адиабатическое сжатие, переводящее рабочее тело в первоначальное состояние.
Рассчитаем к.п.д. цикла Карно в случае, если в качестве рабочего тела используется идеальный газ, масса которого равна 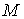 . Уравнение адиабаты для переменных температура
. Уравнение адиабаты для переменных температура 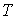 и объем
и объем 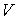 имеет вид:
имеет вид: 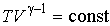
Применение этого уравнения к процессам 2-3 и 4-1 позволяет получить условия
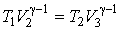 , , 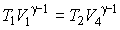
|
Деление выражения дает: 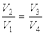
Учитывая, что процессы 1-2 и 3-4 являются изотермическими и, следовательно, происходят без изменения внутренней энергии газа, для получаемой 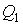 и отдаваемой
и отдаваемой 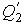 теплоты на основании первого начала термодинамики и формулы можно записать
теплоты на основании первого начала термодинамики и формулы можно записать
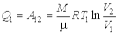 , , 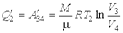
|
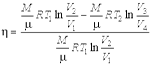
Подстановка полученных выражений в формулу дает выражение
которое, в свою очередь, с учетом соотношени е преобразуется к виду: 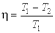
Полученное выражение позволяет определить коэффициент полезного действия цикла Карно обратимой тепловой машины, если в ней в качестве рабочего тела используется идеальный газ. Из приведенных формул следует, что к.п.д. такой тепловой машины всегда меньше единицы и полностью определяется температурами нагревателя и холодильника.
26. приведенное кол-во теплоты – отношение кол-ва тепла полученного системой от тела, к темпиратуре этого тела. 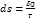
В адиабатически изолированной термодинамической системе энтропия не может убывать: она или сохраняется, если в системе происходят только обратимые процессы, или возрастает, если в системе протекает хотя бы один необратимый процесс.
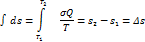
27.Реальные газы: газы, диаметр молекул которых не равен 0(не материальные точки), между ними есть силы взаимодействия, и их соударения не абсолютно упругие.
1. v→v-b b~4v
2.p→p+p’
P’= 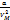
(P+ 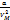 )(
)(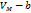 )=RT –для 1 моля
)=RT –для 1 моля
Для 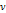 молей:
молей: 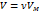
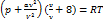 |*
|* 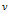 ,
, 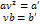
(P+ 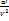 )(
)(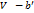 )=
)= 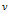 RT
RT
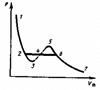
7-6- умен. Объём пары насыщ.
6-5пар переходит в жидкость
5-3 перенасыщенный пар
3- пар перешёл в жидкость
2-1- сжатие жидкости
При Ткр участок 2-6 исчезает пар переходит в жидкость минуя стадию насыщения
30. Электрический заряд – это физическая величина, характеризующая свойство частиц или тел вступать в электромагнитные силовые взаимодействия.
Ему присущи следующие фундаментальные свойства:
1) электрический заряд существует в двух видах: отрицательные и положительные заряды;
2) Электрический заряд дискретен;
3) алгебраическая сумма электрических зарядов замкнутой системы остается постоянной (закон сохранения электрического заряда);
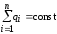 или
или 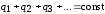 ,
,
4) электрический заряд - величина релятивистки инвариантная, т.е. не зависит от системы отсчета, а значит, не зависит от того, движется заряд или покоится.
Закон Кулона:
Сила взаимодействия двух неподвижных точечных электрических зарядов в вакууме прямо пропорциональна произведению их модулей и обратно пропорциональна квадрату расстояния между ними. Она направлена вдоль прямой, соединяющей заряды, и является силой притяжения, если заряды разноименные, и силой отталкивания, если заряды одноименные.

31.Силовая характеристика электрического поля – вектор напряженности, который можно найти по формуле:
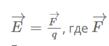 - сила, действующая со стороны поля на неподвижный (пробный) заряд q. Его значение должно быть настолько мало, чтобы отсутствовала возможность искажать поле, напряженность которого с его помощью и измеряют. По уравнению видно, что напряженность совпадает по направлению с силой, с которой поле действует на единичный положительный пробный заряд.
- сила, действующая со стороны поля на неподвижный (пробный) заряд q. Его значение должно быть настолько мало, чтобы отсутствовала возможность искажать поле, напряженность которого с его помощью и измеряют. По уравнению видно, что напряженность совпадает по направлению с силой, с которой поле действует на единичный положительный пробный заряд.
У напряженности электростатического поля нет зависимости от времени. Когда она во всех точках поля одинакова, тогда поле называют однородным. В другом случае – неоднородным.
Принцип суперпозиции полей формулируется так:
Если в данной точке пространства различные заряженные частицы создают электрические поля, напряженности которых 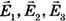 и т. д., то результирующая напряженность поля в этой точке равна:
и т. д., то результирующая напряженность поля в этой точке равна: 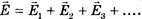 .
.
Принцип суперпозиции полей справедлив для случая, когда поля, созданные несколькими различными зарядами, не оказывают никакого влияния друг на друга, т. е. ведут себя так, как будто других полей нет. Опыт показывает, что для полей обычных интенсивностей, встречающихся в природе, это имеет место в действительности.
Благодаря принципу суперпозиции для нахождения напряженности поля системы заряженных частиц в любой точке достаточно воспользоваться выражением напряженности поля точечного заряда.
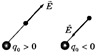
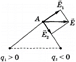
На рисунке ниже показано, как в точке A определяется напряженность поля  , созданная двумя точечными зарядами q1 и q2.
, созданная двумя точечными зарядами q1 и q2.
 32. Линией напряженности электрического поля называется линия, касательная к которой в каждой точке совпадает с вектором напряженности
32. Линией напряженности электрического поля называется линия, касательная к которой в каждой точке совпадает с вектором напряженности 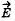
Линии напряженности электростатического поля начинаются на положительных электрических зарядах и кончаются на отрицательных электрических зарядах или уходят в бесконечность.
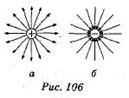 Распределение линий напряженности вокруг точечного заряда показано на рис. 106 а, б.
Распределение линий напряженности вокруг точечного заряда показано на рис. 106 а, б.
Определяя направление вектора 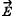 в различных точках пространства, можно представить картину распределения линий напряженности электрического поля.
в различных точках пространства, можно представить картину распределения линий напряженности электрического поля.
 Для двух одноименных зарядов эта картина имеет вид, показанный на рис. 107, для разноименных — на рис. 108.
Для двух одноименных зарядов эта картина имеет вид, показанный на рис. 107, для разноименных — на рис. 108.
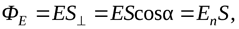 Итак, на примерах мы показали, что, если силовые линии однородного электрического поля напряженностью пронизывают некоторую площадкуS, топоток вектора напряженности(число силовых линий через площадку) будет определяться формулой
Итак, на примерах мы показали, что, если силовые линии однородного электрического поля напряженностью пронизывают некоторую площадкуS, топоток вектора напряженности(число силовых линий через площадку) будет определяться формулой
где En– произведение векторана нормальк данной площадке (рисунок 2.5).
Полное число силовых линий, проходящих через поверхность S, называется потоком вектора напряженности ФЕ через эту поверхность.
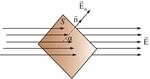
Элементарный поток вектора напряженности через площадку dS(рис. 5) определится соотношением:
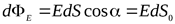
где 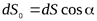 – проекция
– проекция 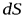 на направление нормали
на направление нормали 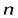 .
.
В векторной форме можно записать 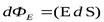 – скалярное произведение двух векторов, где вектор
– скалярное произведение двух векторов, где вектор 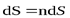 .
.
Таким образом, поток вектора 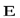 есть скаляр, который в зависимости от величины углаα может быть как положительным, так и отрицательным.
есть скаляр, который в зависимости от величины углаα может быть как положительным, так и отрицательным.
Полный поток вектора напряженности через любую площадку Sможно определить тогда 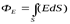 , а поток через замкнутую поверхность, окружающую заряд или заряженное тело равен
, а поток через замкнутую поверхность, окружающую заряд или заряженное тело равен 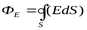 .
.
Так как напряженность поля, созданного в любой точке пространства зависит от величины заряда, создающего это поле, то поток вектора напряженности электростатического поля через любую площадку, находящуюся в этом поле также зависит от величины заряда.
 2020-01-15
2020-01-15 274
274