 3.1. Применение мультимедийной аппаратуры в химическом демонстрационном эксперименте.
3.1. Применение мультимедийной аппаратуры в химическом демонстрационном эксперименте.
Реализация одного из важнейших принципов - наглядности в обучении не всегда может быть достигнута через прямой показ опытов или демонстрацию свойств химических веществ и процессов. Использование мультимедийной аппаратуры: графопроекторов, эпи- и диапроекторов, компьютеров, теле-, видеоаппаратуры, DVD, цифровой записи позволяет расширить диапазон использования демонстрационного эксперимента.[1] Наибольшую эффективность сочетания демонстрационного эксперимента и мультимедийной аппаратуры можно достигнуть в следующих случаях:
■1.)При демонстрации медленно протекающих процессов в силу слабой выраженности их внешних эффектов.(движение ионов, диффузия, кристаллизация) Примеры опытов:
Диффузия веществ в любых агрегатных состояниях.
Опыт 1. В чашку Петри наливают воду и помещают несколько кристалликов медного купороса (или перманганата калия, дихромата калия). Учащиеся наблюдают диффузию, сопровождающуюся разрушением кристаллов, появлением окрашенных струек и увеличением размера окрашенного пятна. [23]
Опыт 2. На стеклянную пластинку или в чашку Петри помещают каплю крахмального клейстера и рядом с каплей - кристаллик йода. Через несколько секунд крахмал синеет со стороны кристаллика и происходит диффузия паров йода. Данный и следующий опыты демонстрируют диффузию в газе.
Опыт 3. На расстоянии 2- 3 см. друг от друга на стеклянную пластинку или в чашку Петри помещают капли фенолфталеина и водного раствора аммиака. Через несколько секунд капля фенолфталеина становится малиновой.
Опыт 4. В чашку Петри наливают жидкий крахмальный клейстер, чтобы исключить конвекцию. На противоположных сторонах чашки помещают кристаллики медного купороса и гидроксида аммония. Учащиеся  наблюдают диффузию веществ, а на границе их взаимодействия –образование сине-фиолетовой зоны аммиачного комплекса меди, которая непрерывно расширяется. [18]
наблюдают диффузию веществ, а на границе их взаимодействия –образование сине-фиолетовой зоны аммиачного комплекса меди, которая непрерывно расширяется. [18]
Кристаллизация.
Демонстрация процессов кристаллизации. В узкую кювету налить пересыщенный раствор ацетата натрия. От степени пресыщения зависит успех опыта. Поэтому для различных температурных условий требуется разное количество влитой воды в 3-водном кристаллогидрате ацетата натрия, чтобы достигнуть нужной степени пресыщения. Чем меньше степень пресыщения, тем эффективнее опыт, так как растут большие игольчатые кристаллы во весь экран. Обычно опыт удается, если смешать 2 массовые доли кристаллогидрата и 1 массовую долю воды. Кристаллизацию вызывают, помещая один кристаллик затравки этой или другой соли. Опыт может быть продемонстрирован и как занимательный. Кроме ацетата натрия можно использовать кристаллогидрат тиосульфата натрия. И в этом случае к 3 частям кристаллогидрата следует добавить 1 часть воды. Разбавление и растворение можно проводить в кювете, поместив ее в теплую воду и перемешивая содержимое лучинкой, чтобы не поцарапать стекло. [16]
Движение ионов.
Направленное движение ионов под действием электрического поля рекомендуется осуществлять не в воде, а в крахмальном клейстере, в котором содержится электролит (10%-ный раствор Na2SO4). В этом случае система приобретает устойчивость, т. е. раствор крахмала, обладающий вязкостью, препятствует самопроизвольному движению раствора, мешающему наблюдать истинное движение ионов. Однако надо учитывать раз меры ионов. Чем сильнее сольватирован ион, тем больше его диаметр и тем меньше его подвижность. Поэтому для демонстрации лучше всего использовать гидроксид-ионы, которые имеют подвижность 0,0018 см/с, уступая только катионам водорода 0,0033 см/с в поле с градиентом 1 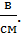 В чашку Петри на расстоянии 20-25 мм. друг от друга помещают два угольных электрода от старых отечественных гальванических элементов (батареек), изолируют и фиксируют их с помощью силиконовой (или каучуковой) трубки. Для удобства наблюдения цветной изоляционной лентой или перманентным маркером помечают полюса: анод (+) и катод (-). [23]
В чашку Петри на расстоянии 20-25 мм. друг от друга помещают два угольных электрода от старых отечественных гальванических элементов (батареек), изолируют и фиксируют их с помощью силиконовой (или каучуковой) трубки. Для удобства наблюдения цветной изоляционной лентой или перманентным маркером помечают полюса: анод (+) и катод (-). [23]
Чашку Петри помещают на стекло графопроектора. Между электродами наливают свежеприготовленный крахмальный клейстер (тонкий слой), в который добавлено несколько капель сульфата натрия. Между  электродами располагают белую хлопчатобумажную нить, смоченную темно-зеленым прозрачным раствором хромата тетраамминмеди (II) [Cu(NH3)4]CrO4 который готовят путем смешивания равных объемов 5-10%-ных растворов хлорида меди (II) и хромата калия с добавлением 10-25%-ного раствора аммиака до растворения осадка:
электродами располагают белую хлопчатобумажную нить, смоченную темно-зеленым прозрачным раствором хромата тетраамминмеди (II) [Cu(NH3)4]CrO4 который готовят путем смешивания равных объемов 5-10%-ных растворов хлорида меди (II) и хромата калия с добавлением 10-25%-ного раствора аммиака до растворения осадка:
СuС12 + К2CrO4 = CuCrO4 ↓+ 2KC1
CuCrO4 + 4NH3∙H2O = [Cu(NH3)4]CrO4 + 4Н2О [15 ]
В растворе это комплексное соединение подвергается диссоциации:
[Cu(NH3)4]CrO4 ↔[Cu(NH3)4]2+ + CrO42-
Сначала по обе стороны от нитки видно зеленое окрашивание (синий + желтой = зеленый), но после включения постоянного тока через выпрямитель ВС-24М (В-24) учащиеся наблюдают направленное движение ионов в виде окрашенных полос: синей [Cu(NH3)4]2+ - к катоду (-) и желтой CrO42- - к аноду (+).
Аналогичный опыт можно продемонстрировать с помощью той же установки, смочив хлопчатобумажную нить смесью концентрированных растворов хлорида железа (III) и перманганата калия. При включении тока будет хорошо заметно движение ионов в виде окрашенных полос: желто-бурой Fe3+ - к катоду (-) и красно-фиолетовой МnО42-- к аноду (+).
Подвижность ионов водорода можно показать, используя растворы соляной или серной кислот и индикаторы метиловый оранжевый (кислотная форма красная), лакмоид (цвет кислотной формы тоже красный), а подвижность гидроксид-ионов - с помощью растворов гидроксида натрия или калия и индикатора фенолфталеина (щелочная форма малиновая). [23]
■2.)При демонстрации процессов с участием веществ в высокодисперсном состоянии: броуновского движения, флотации, требующих применения микроскопа или другой аппаратуры для увеличения, например кодоскопа.
Флотация.
Демонстрация флотации. В узкую кювету помещают мелкую крошку цветного органического стекла (размером 1-1,5 мм.) и такую же крошку битого бутылочного стекла контрастного или  ионообменную смолу. Наливают до половины кюветы воды и барботируют воздух. Органическое стекло гидрофобно по отношению к воде и всплывает на поверхность, а силикатное, или ионообменная смола - гидрофильны и не всплывают. Однако как только пузырьки воздуха лопнут, кусочки органического стекла начинают также тонуть. Добавляют несколько капель моющего средства или скипидара. Образуется устойчивая пена и органическое стекло всплывает, а силикатное стекло или смола остаются на дне. При достаточной контрастности цвета это хорошо видно на экране.[28]
ионообменную смолу. Наливают до половины кюветы воды и барботируют воздух. Органическое стекло гидрофобно по отношению к воде и всплывает на поверхность, а силикатное, или ионообменная смола - гидрофильны и не всплывают. Однако как только пузырьки воздуха лопнут, кусочки органического стекла начинают также тонуть. Добавляют несколько капель моющего средства или скипидара. Образуется устойчивая пена и органическое стекло всплывает, а силикатное стекло или смола остаются на дне. При достаточной контрастности цвета это хорошо видно на экране.[28]
Броуновское движение
Для демонстрации броуновского движения наиболее подходящим объектом является дым от сигареты. Опыт проводится при боковом освещении, сконцентрированном линзой. В качестве камеры наблюдения можно использовать спичечную коробку с проделанным боковым отверстием- для освещения и верхним отверстием – для наблюдения. Камера должна быть герметичной, поэтому отверстия закрываются покровными стеклами сбоку и сверху. Наблюдение производится при помощи микроскопа. При массовом характере демонстраций опыт лучше заснять на видеокамеру через микроскоп. Броуновское движение в газе, особенно высокодисперсных частиц дыма, наблюдается в виде «роящегося облачка» мелких насекомых. Из-за малых размеров частицы дыма наблюдаются в виде звездочек.
■3.) Демонстрации свойств и химических процессов с участием сильно токсичных или экологически опасных веществ.(галогенов, некоторых соединений азота, фосфора, тяжелых металлов и т.д. Несколько подобных опытов приведено в нашем DVD-сборнике: пирофорные свойства нанопорошка свинца, получение фосфина и его возгорание на воздухе, самовозгорание белого фосфора на воздухе. Примеры:
Сравнительная характеристика свойств галогеноводородов
1. КСI + H2SO4 = KHSO4 + НСI
2. 2KBr + 2H2SO4= K2SO4 + Br2 + SO2 + 2H2O
3. 8KI+5H2SO4 = 4I2 + H2S + 4K2SO4 + 4H2O [15]
Подготовка.Три демонстрационные пробирки или стакана. Хлорид, бромид и иодид калия (сухие соли). Концентрированная серная кислота. Раствор Pb(NO3)2.
Выполнение.Поместив перед белым экраном три пробирки, насыпать в них по отдельности небольшие порции сухих хлорида, бромида и иодида калия. Затем прилить поочередно концентрированную серную кислоту. В пробирке с хлоридом калия выделяется бесцветный хлористый водород; с влагой воздуха он образует туман (перенести пробирку на черный фон). В пробирке с бромидом калия сперва также виден беловатый туман бромистого водорода. Однако вследствие окисления бромистого водорода серной кислотой вскоре в пробирке появляются красно-бурые пары брома. Приливание серной кислоты в пробирку с иодидом калия вызывает выделение иода: йодистый водород тотчас же окисляется серной кислотой, которая восстанавливается при этом до свободной серы или даже сероводорода. Покрыв пробирку фильтром, смоченным раствором соли свинца, — появляется черное пятно. [11 ] Для большей эффективности опыт лучше демонстрировать в видеозаписи с большим увеличением.
Свойства фтороводорода
Работа с фтористым водородом представляет большие трудности и даже опасность. Поэтому здесь предлагается только один из наиболее простых опытов с раствором фтористого водорода.
Травление стекла плавиковой кислотой
Подготовка.Стеклянная пластинка, покрытая парафином (или воском). Игла или гвоздь. Помазок. Плавиковая кислота. Бензин.
Опыт проводится под тягой, т.к. плавиковая кислота разрушает дыхательные пути, а для учащихся демонстрировать только в виде видеозаписи.
Выполнение.Нацарапать иглой или гвоздем на пластинке, покрытой парафином, какое-нибудь слово. Бороздки, проведенные иглой, должны доходить до поверхности стекла. Затем помазком нанести на пластинку плавиковую кислоту (осторожно, избегать попадания кислоты на руки!) и так оставить на несколько минут. Смыть плавиковую кислоту большим количеством воды и снять бензином парафин. При боковом освещении на черном экране на пластинке будет четко видно написанное слово. При отсутствии раствора плавиковой кислоты в пластмассовую чашку вносят смесь фторида натрия с концентрированной серной кислотой и закрывают сверху подготовленной стеклянной пластинкой. [11]
Получение хлороводорода(горение водорода в хлоре)
Подготовка.Цилиндр, наполненный хлором. Источник водорода (аппарат Киппа). Раствор лакмуса. Изогнутая стеклянная трубка с оттянутым концом.
Выполнение.Соединить изогнутую стеклянную трубку с источником водорода. Пропустив водород через трубку некоторое время, его поджечь (в случае аппарата Киппа обязательно испытать предварительно водород на чистоту). Осторожно опустить трубку в цилиндр с хлором. Водород продолжает гореть, пламя удлиняется и приобретает более заметную желто-зеленую окраску. По окончании опыта налить в цилиндр синий раствор лакмуса. Он краснеет от образовавшейся соляной кислоты. Если есть еще хлор, не вошедший в реакцию, лакмус обесцвечивается. [15]
Опыт можно провести только под хорошей тягой, но наиболее удобной является его демонстрация через видеозапись. Преимущество такой демонстрации: резко уменьшаются затраты на проведение, его можно показать в 10 классе для активизации познавательной деятельности.
■4.)Демонстрации опытов, сопровождающихся взрывным характером взаимодействия: гремучей смеси водорода с кислородом, метана и ацетилена с кислородом, галогенов с водородом и др.
Взрыв смеси водорода с кислородом
Подготовка.Цилиндр емкостью 250—300 мл. с пришлифованной пластинкой и разделенный метками на три равные части. Полотенце (мокрое).
Путем вытеснения воды ввести в цилиндр два объема водорода и один объем кислорода. Закрыть пришлифованной пластинкой (или стеклышком, смазанным вазелином). Для смешивания газов цилиндр несколько раз перевернуть (придерживая пластинку пальцем) и вынести в класс.
Выполнение.Обернуть для предосторожности цилиндр мокрым полотенцем и поставить на стол. Зажечь лучину и, сняв пластинку, закрывающую цилиндр, поднести огонь к отверстию цилиндра. Раздается сильный взрыв. [11] Опыт хорошо демонстрировать через прямой показ, но для повторной демонстрации возможен показ через видеозапись в старших классах, где для этих опытов время не отведено.
Синтез хлористого водорода (фотореакция)
При ярком освещении соединение хлора с водородом происходит со взрывом. Подготовка опыта опасна и требует внимания и осторожности. [8]
Подготовка.Источник водорода. Прибор для получения хлора. Плоскодонная колба емкостью 200—250 мл.с хорошо подобранной резиновой пробкой. Кристаллизатор. Асбестовая сетка. Зажигательная смесь (1 г Mg + 1 г КС1О3). Полоски фильтровальной бумаги, пропитанные раствором нитрата калия и высушенные. Лучинки. Предохранительный ящик со стенками из частой сетки. Для демонстраций удобен предохранительный ящик, у которого дно деревянное (из фанеры), три стенки — из органического стекла (одна из них должна быть подвижной), четвертая стенка и верх — из частой медной сетки. Примерные размеры ящика 40Х40Х75 см. [11]
Точно измерить объем хорошо вымытой колбы, разделить его пополам, нанеся на колбу метку восковым карандашом. Наполнив колбу водой, поместить ее вверх дном в кристаллизатор с водой и наполнить водородом до метки (1/2 объема). Затем перенести кристаллизатор и колбу, укрепленную в штативе, в предохранительный ящик. После этого спустить дверцу ящика так, чтобы проходила только рука с отводной трубкой от прибора для получения хлора. Надеть защитные очки и слегка затемнить помещение. Поднести к ящику прибор для получения хлора и дополнить хлором колбу вытеснением оставшейся в ней воды. Как только весь объем колбы заполнится, отводную трубку вынуть, прибор убрать и под водой плотно закрыть колбу пробкой. [15] Вытащить из ящика кристаллизатор и спустить дверцу. Ящик тотчас же вынести на демонстрационный стол в аудиторию.
Выполнение.На асбестовую сетку поместить бумагу, пропитанную нитратом калия, на нее насыпать зажигательную смесь (около одной чайной ложки). Штатив с сеткой поместить перед ящиком таким образом, чтобы зажигательная смесь была ниже шарика колбы.
Лучинкой поджечь кончик бумажной полоски. Как только зажигательная смесь вспыхнет, происходит сильный взрыв, вверх взлетает грибообразный клубок хлористого водорода. Колба разлетается в мелкие осколки.
Примечание.Опыт очень эффектен и в аудитории совсем безопасен, так как все осколки колбы остаются внутри ящика. Но подготовка опыта к демонстрации требует тщательной отработки и большой осторожности. Взрыв хлора с водородом может вызвать не только яркий свет, но и катализатор. Им может быть пыль и труха в стенках резиновой трубки, загрязненная или разъеденная поверхность колбы и т. п. В таких случаях взрыв происходит неожиданно в момент заполнения колбы хлором. Поэтому даже после тщательного промывания всех частей прибора колбу следует заполнять хлором только под защитной сеткой в предохранительном ящике. Лицо экспериментатора должно быть защищено маской. [9]
Взрыв при взаимодействии хлората калия с серной кислотой
Подготовка.Пробирки. Спиртовка. Предохранительный ящик. Хлорат калия (КС1О3). Концентрированная серная кислота.
Выполнение.Пробирку с небольшим количеством хлората калия укрепить в штативе и поместить в предохранительный ящик. (Укрепить пробирку следует так, чтобы пламя горящей спиртовки могло касаться дна пробирки.) Приготовив спиртовку, прилить в пробирку с хлоратом калия 2 к. концентрированной серной кислоты. Содержимое пробирки сразу же желтеет (С1О2). Быстрым движением подставить горящую спиртовку под пробирку. (Руку убрать!) Раздается взрыв, слышен резкий характерный звук. Пробирка может разорваться на куски! [11]
Получение йодистого азота
Йодистый азот еще более неустойчив, чем хлористый,
и в сухом виде взрывается уже от малейшего прикосновения,
Подготовка. К небольшому количеству (20— 25 мл.) концентрированного раствора йода (в растворе иодида калия) прилить концентрированный раствор аммиака. Выделяется темно-коричневый осадок йодистого азота. Осадок отфильтровать и промыть небольшим количеством спирта. Тотчас же мокрый осадок разложить при помощи шпателя маленькими комочками на отдельные 2—3 листа фильтровальной бумаги. Угол бумаги отогнуть и положить листки в безопасное теплое место (например, вблизи батарей парового отопления). Через несколько часов препарат высохнет и его можно использовать для демонстрации. Стакан, в котором проводилось осаждение, воронку и фильтр сначала залить раствором щелочи, дать постоять и только затем вымыть.[15]
Выполнение.Взяв за угол листок бумаги с комочком йодистого азота, осторожно, на вытянутой руке внести в аудиторию. Положить листок на пол, ударить комочек деревянной указкой. Раздается сильный взрыв. Неиспользованный препарат взорвать после урока. Опыт эффективен при непосредственном показе, но эффективность не теряется при показе видеозаписи, что более удобно.
■5.)Демонстрации каталитических процессов, требующих длительной подготовки и сложной аппаратуры в сочетании с показом промышленных установок, где эти процессы используются, позволяют усилить политехническую профориентационную направленность в обучении; Пример:
Получение серного ангидрида контактным способом.
1.)Подготовка прибора. В качестве катализатора для опыта обычно пользуются платинированным асбестом. Платиновый катализатор с успехом может быть заменен нанесенным на асбестовую вату оксидомжелеза Fe2O3 (И.П. Вязовский). Асбестовая вата прокаливается в тигле. Затем рыхлые комочки ваты встряхиваются в банке с порошком оксида железа, пока асбест не будет им как бы «напитан». Этими комочками наполняется трубка А прибора. Для нагревания можно воспользоваться двумя спиртовками или горелкой. [25]
Вместо того чтобы встряхивать порошок окиси железа с асбестовой ватой, можно пропитать асбест раствором железного купороса (FeSO4) и затем прокалить до полного разложения соли.

|
Трубка Азакрывается с обоих концов хорошо подогнанными пробками, в которые вставлены прямая трубка аи изогнутая трубка б. Нижнее колено трубки б должно не доходить на 3—4 см до дна пробирки Д, погруженной в стакан Г.
Серный ангидрид очень энергично действует на корковую пробку, но хорошая пробка свободно выдерживает один и даже два опыта (пробный и на уроке). Для того чтобы продукты действия серного ангидрида на пробку не могли попасть в газоотводную трубку б, последняя должна немного выставляться внутрь трубки А. [25]
Кроме того, пробки полезно защищать надетыми на трубки кружочками асбестового картона или хотя бы комочками асбестовой ваты.
На резиновую пробку серный ангидрид действует несколько менее сильно, чем на корковую, и потому пробку, в которую вставлена трубка б, можно взять резиновую, но она также быстро портится. [11]
Для получения сернистого газа удобнее всего воспользоваться действием серной кислоты H2SO4 на Na2SO3. Соль можно поместить в колбу Б, как на рисунке, или в какой-нибудь другой сосуд. Кислород берется из газометра.
Для осушения и смешивания оба газа пропускают через одну и ту же банку Вс концентрированной серной кислотой. Для этого в пробку банки Ввставлены три трубки. Трубка, отводящая газ, соединяется или непосредственно с трубкой А.[25]
Резиновая трубка, соединяющая трубку ас осушительным аппаратом, должна быть достаточно длинной. Нужно, чтобы трубку Аможно было свободно поднять вместе со штативом для вынимания пробирки Диз стакана Г.В стакан Гпомещается лед. Стакан лучше всего, взять батарейный
Пробирка Д,служащая для собирания серного ангидрида, должна быть средней величины. Следует иметь также 2—3 запасные пробирки. К пробиркам до урока нужно подобрать хорошие корковые пробки. Горелку полезно снабдить насадкой для плоского пламени.
Если нагревание ведется на спирту, то следует взять спиртовку с плоским фитилем или расправить фитиль в виде веера.
Когда прибор собран, пропустить через него в течение некоторого времени из газометра воздух, нагревая при этом платинированный асбест возможно сильнее, чтобы удалить из асбеста и из прибора всю влагу. После этого дать трубке Аостыть не прекращая тока воздуха. Весь прибор необходимо поместить под тягу.
Получение серного ангидрида
Приготовить охладительную смесь.(из льда и поваренной соли) Отставив пока стакан со смесью в сторону, приоткрыть кран воронки прибора для получения сернистого газа настолько, чтобы серная кислота капала не слишком частыми каплями и из прибора выделялся равномерный ток газа. Открыть кран газометра и отрегулировать ток кислорода таким образом, чтобы он был примерно вдвое слабее, чем ток сернистого газа, так как с двумя объемами SO2 реагирует один объем O2 по реакции:
2SO2+ O2 =2SO3
Обратить внимание учащихся на то, что при обыкновенной температуре никакой реакции между сернистым газом и кислородом не замечается. Начать осторожно нагревать трубку А,держа горелку в руке. Когда трубка прогреется, подставить горелку и отрегулировать пламя или высоту горелки таким образом, чтобы конец пламени едва касался трубки А,не обхватывая ее.
Наилучшая температура для реакции около 400°, но при демонстрационном опыте точного измерения температуры не требуется.
Когда трубка Апрогреется и из трубки бначнется выделение белого дыма, отрегулировать ток газов таким образом, чтобы было обильное выделение дыма, и, подняв трубку Авместе со штативом, погрузить трубку б в пробирку Д, находящуюся в охлаждающей смеси. Через 5 минут собирается достаточное количество твердого SO3 . На этом опыт получения серного ангидрида заканчивается. [25]
Данный опыт целесообразнее показывать в форме видеозаписи, что позволяет избежать значительных затрат времени на подготовку и проведение эксперимента.
■6.)Демонстрация быстро протекающих процессов в «замедленной съемке» и многократной повторной демонстрацией, например, горение пороховых смесей, взрывные процессы и тд.
В нашем сборнике в опытах 1,2,6 используется замедленное воспроизведение и повторный показ ключевого момента эксперимента. В опыте «мыльные пузыри наполненные водородом» данный эффект использован для показа момента поднятия пузыря и его воспламенения; в опыте «летающая банка» -момент взрывного горения,фактически не заметного невооруженным глазом; в опыте «получение фосфина»- момент самовоспламенения газа и образования вихревого кольца, что позволяет не только в деталях рассмотреть чрезвычайно быстрые процессы, но и обратить внимание учеников на важные детали плохо доступные при обычном восприятии.
■7.)В записи «демонстрационный эксперимент» может стать домашним, усилив, таким образом, мотивационную и развивающую составляющие обучения и воспитания. Для домашней демонстрации видеозапись опытов может быть перезаписана на Flesh-карту или DVD-диск и передана учащимся для домашнего просмотра.
■8.)Широкое распространение такого рода эксперимент может найти на занятиях во внеурочное время, для учащихся в элективных курсах с углубленным изучением химии.
Из недостатков можно отметить тот факт, что не все свойства можнодемонстрировать таким образом.
 2020-01-15
2020-01-15 300
300








