МОРДОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ИМЕНИ Н.П. ОГАРЕВА
Институт физики и химии
Кафедра аналитической химии
КУРСОВАЯ РАБОТА
ВЛИЯНИЕ АНТИГОЛОЛЕДНОГО ПОКРЫТИЯ НА КОРРОЗИОННУЮ СТОЙКОСТЬ УГЛЕРОДИСТОЙ СТАЛИ
Автор курсовой работы 27.06.2011 М.В. Девяткина Обозначение курсовой работы КР-02069964-020101-04-11
Специальность 020101 химия
Руководитель работы
канд. хим. наук, доцент 27.06.2011 А.К. Осипов
Оценка
Саранск 2011
МОРДОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ИМЕНИ Н.П. ОГАРЕВА
Институт физики и химии
Кафедра аналитической химии
ЗАДАНИЕ НА КУРСОВУЮ РАБОТУ
Студентка Девяткина М.В.
1 Тема: Влияние антигололедного покрытия на коррозионную стойкость углеродистой стали
2 Срок предоставления работы к защите: 27.06.10 г.
3 Исходные данные для курсовой работы: литературные данные, постановка цели и задачи исследования
4 Содержание курсовой работы
4.1 Аналитический обзор
4.2 Экспериментальная часть
4.3 Результаты и их обсуждение
4.4 Выводы
Руководитель курсовой работы 8.02.2011 Осипов А.К.
Задание принял к исполнению 8.02.2011 Девяткина М.В.
Содержание
Введение 4
1 Аналитический обзор 6
1.1 Коррозионное поведение углеродистых сталей в растворах солей 6
1.2 Анодное поведение углеродистых сталей и цветных металлов в органических растворах 9
1.2.1 Азотсодержащие соединения 10
1.2.2 Соединения с кратными связями 14
1.2.3 Кислородсодержащие соединения 17
1.3 Растворение и пассивация железа в щелочных растворах 19
2 Экспериментальная часть 22
2.1 Электрохимические методы анализ 22
2.2Методика потенциометрического определения 24
2.3 Подготовка электродов для электрохимических измерений 26
2.4 Приготовление рабочих растворов 28
3 Результаты и их обсуждение 29
3.1 Анодное поведение углеродистой стали в исходных растворах 29
3.2 Анодное поведение стали Ст 85 в смесях солей 31
3.3 Скорость коррозии в чистых растворах 34
4 Выводы 36
5 Список использованных источников 37
Введение
В зимний период времени возникают не малые трудности в эксплуатации транспортных магистралей, прежде всего городских дорог, бетонных дорожек аэропортов, аэродромов в силу образования гололеда. Главной задачей уборки магистралей и улиц в зимний период является предупреждение образования наледи на дорогах. Основной технологической операцией зимней механизированной уборки является обработка проезжей части противогололедными материалами.
Зачастую дорожные службы, эксплуатационники не учитывают степень агрессивного воздействия применяемых антигололедных реагентов на транспортные средства и покрытия, особенно этим страдают коммунальные службы населенных пунктов, где основным средством борьбы с гололедом является галит (каменная соль). Завоевавшим наибольшую популярность в борьбе с гололедом, а также наиболее дешевым средством является галит (соль техническая, хлорид натрия). Также используется смесь галита (соли технической, натрия хлористого, хлорида натрия) с песком и щебнем, которые добавляются для уменьшения коэффициента скольжения и увеличения сцепных качеств (пескосоляные смеси). Лишь на более важных объектах прибегают к использованию менее агрессивных средств, но опять же не учитывая экономическую сторону вопроса.
В зависимости от климатических условий и интенсивности движения автомобилей в зимние периоды года при гололеде ежедневно расходуется от 10 до 150 г соли (NaCl) на 1 м2 дорожного покрытия.
Темой нашего исследования явилось снижение агрессивного влияния антигололедного реагента путем введения веществ, снижающих коррозионные потери конструкционных материалов машин и дорожных покрытий.
Многие из факторов, характеризующих химические и физические свойства среды окружающей систему, оказывают глубокое влияние на природу и ее интенсивность. Тривиально, но очевидный факт, свидетельствует о снижении коррозии с падением кислотности раствора. Когда раствор становится щелочным и коррозия уменьшается, наступает естественное ингибирование.
Поэтому, целью настоящей курсовой работы является исследование влияния антигололедного покрытия на коррозионную стойкость углеродистой стали Ст.85.
Задачи курсовой работы:
1) провести коррозионные испытания стали Ст.85 в растворе галита.
2) провести электрохимические испытания стали Ст.85 в растворах галита с добавлением различных солей.
3) провести электрохимические испытания образца арматуры Ст.85, в растворе тройной системы “галит-мочевина-гидрокси́д ка́льция” в разных соотношениях.
Аналитический обзор
Коррозионное поведение углеродистых сталей в растворах солей
С.М. Решетников отмечает участие анионов фона, в частности ОН--ионов, в промежуточных стадиях процесса. Адсорбция ПАВ влияет на соотношение скоростей стадий анодного процесса и его кинетические параметры [1, 2—5].На примере анодного растворения железа в сульфатных растворах рассмотрим влияние ингибиторов.
Схема анодного процесса в присутствии ингибиторов*:
Fe + H20 + Inh ↔[Fe(OH)(Inh)]адс + Н++ е- (3.1а)
[Fe(OH) (Inh)]адс + S02-4 ↔[Fe(OH)(SO4) ]2-адс + Inh (3.1б)
[Fe(OH)(SO4) ]2-адс → Fe2+ + ОН- + S02-4 + е- (3.1в)
С.М. Решетниковым рассматривается как одновременно протекаю-
щая адсорбция молекул воды, которая завершается образованием
ОН-адс и адсорбция частиц ПАВ. Будет ли это сопровождаться ингибированием или стимулированием анодного процесса, зависит от прочности адсорбционного комплекса, образовавшегося на этой стадии, его способности претерпевать дальнейшие превращения в конечный продукт анодного процесса — гидрйтированные ионы Fe+2.
Стадию (3.1б) рассматривается как конкурирующую адсорб-
ция анионов сульфата, имеющихся в растворе, и частиц ПАВ. Эта ста-
дия завершается вытеснением из адсорбционного комплекса частиц ин-
гибитора с образованием соединения, в состав которого входят два
вида анионов, ускоряющих процессанодного растворения.
Конечный продукт анодного растворения железа—ионы Fe+2—появляется в ходе стадии (3.1в),которая определяет скорость всего процесса.
С.М. Решетников используя преобразования, получает следующее кинетическое уравнение:
jа= kа [OH-]°,5p [Inh]0,5р-1 exp [(p + 1) FE/RT] (3.2)
При р < 2 величина vinh<0 и ПАВ будет уменьшать скорость анодной реакции, т. е. служить ингибитором. При р > 2 величина vinh > 0 и ПАВ будет увеличивать скорость анодной реакции, т. е. служить стимулятором. Иначе говоря, в зависимости от отношения
степеней заполнения (р) поверхности адсорбционными комплексами, содержащими и не содержащими ПАВ (а это, в свою очередь, определяется в частности прочностью адсорбционных связей ПАВ — металл), будут реализоваться случаи ингибирования (р<2), стимулирования (р>2)или независимости (р=2) скорости анодного процесса от наличия ПАВ.
С учетом поверхностной активности ионов сульфата на железе
обосновывается другая схема анодного процесса:
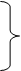 Fe + S02-4 + Inh ↔[Fe(SO4)(Inh)]-адс + е- (3.4a)
Fe + S02-4 + Inh ↔[Fe(SO4)(Inh)]-адс + е- (3.4a)
[Fe(SO4)(Inh)]-адс + H2O ↔[Fe(SO4)(OH)]2-адс + H+ + Inh (3.46)
[Fe(SO4)(OH)]2-адс→ Fe2+ + SO2-4 + OH- + е- (3.4b)
Схема 3.4 предусматривает одновременную адсорбцию ионов сульфата и ингибитора на стадии (3.4а) с последующим адсорбционным
вытеснением ингибитора водой на стадии (3.46). Говорится о приблизи-
тельно одинаковой адсорбционной активности ионов сульфата и гидр-
оксида в данных условиях. Распространяя это на ингибированные рас-
творы, можно полагать, что схемы (3.1) и (3.4) равновероятны и про-
текают пераллельно, тем более, что кинетически они неразличимы.
Анодное растворение железа в кислых хлоридных растворах имеет
ряд характерных особенностей, что связано с участием в процессе анионов хлорида.Схема анодного процесса в присутствии ингибиторов:
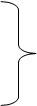 Fe + H2O + Inh ↔[Fe(OH)(Inh)]адс + H+ + е-
Fe + H2O + Inh ↔[Fe(OH)(Inh)]адс + H+ + е-
[Fe(OH)(Inh)]адс + Cl- ↔[Fe(OH)(Cl)]-адс + Inh (3.5)
[Fe(OH)(Cl)]-адс → Fe2+ + OH- + Cl- + е-
Этой схеме соответствует уравнение
jа = ka [ОН-]0.5p [Inh]0.5p-1 exp [(p + 1) FE/2RT] (3.6)
Из всех ионов наиболее агрессивным, по литературным данным, является ион хлора, который в силу этих причин был объектом многочисленных исследований. Агрессивность иона хлора объясняют различным образом. Так, например, Томашов и Модестова [6] указывают, что галоидный анион разрушает окисную защитную пленку, причем скорость разрушения окисных пленок возрастает с увеличением концентрация ионов хлора. Ванюкова и Кабанов [7] считают, что агрессивность иона хлора обусловлена способностью его к адсорбционному вытеснению кислорода с поверхности металла. Акимов [8] агрессивное действие ионов объясняет тем, что ионы способны проникать через пленку, защищающую металл от коррозионной среды. Хедже [9] устанавливает ряд анионов, расположенных в порядке уменьшения их проникающей силы:
Cl- > Br-> J-> F-> SO2-4> NO-3> PO3-4
Из этого ряда видно, что активирующая сила анионов, в основном, уменьшается с увеличением размеров ионов.
Н.Г. Чен при обработке опытных данных делает вывод, что хлорид и сульфат натрия при одинаковых условиях и концентрациях 400 мг/л разрушают металл различно: раствор Na2SO4 оказывается более агрессивным. Однако активирующее действие сульфата падает, примерно, в 1.5 раза, если раствор содержит 50 мг/л фосфатного замедлителя коррозии. При прибавлении к этому раствору 400 мг/л хлорида натрия коррозия увеличивается в 1,2 раза. Если добавить NаС1 в 2 раза меньше, т. е. 200 мг/л, то коррозия возрастает только в 1,1 раза. Таким образом, хлорид натрия, содержащийся в агрессивной среде, увеличивает коррозию металла, причем тем больше, чем выше его концентрация в растворе. Исследование коррозии металла в кипящих растворах NaCl, Na2SO4, СаСl2 и CaS04 показывает, что скорость коррозии с возрастанием концентрации их растворов во всех случаях увели-
чивается, причем у сульфата натрия имеется область концентраций (100—1000 мг/л), при которой наблюдается повышенная скорость коррозии. Если эти соли расположить в порядке уменьшения их агрессивности, то получим следующие ряды:
Na2SO4 > NaCl > СаС12 > CaS04
и при более высокой концентрации, растворов:
NaCl > СаСl2 > Na2S04 > CaS04
При рассмотрении этих рядов обращают на себя внимание два об-
стоятельства. Во-первых, соли Na2SO4 и NaCl имеют одинаковые катио-
ны Na+, но различные анионы S042- и С1-. Следовательно, различное их
агрессивное действие обусловлено только различием их анионов. При
концентрациях раствора ниже 1000 мг/л анион S042- является более аг-
рессивным, чем ион С1-. Во-вторых, соединения Na2S04 и CaS04, NaCl и
СаС12 имеют соответственно одинаковые анионы, но катионы у них раз-
личные. Это весьма сильно сказывается на их агрессивных свойствах:
при наличии в растворе ионов Са2+ сильно снижается агрессивное дей-
ствие анионов, особенно SO2-4.
 2020-01-14
2020-01-14 335
335







