Цель.
На практике определить, как электропроводность сильного электролита зависит от увеличения его концентрации.
Приборы и реактивы.
2. сухое вещество – KCl;
3. Кондуктометр Hanna Hi 8733;
4. Лабораторные электронные весы;
5. Мерная посуда.
План проведения практической работы.
1. Приготовления 1моль/ л раствора KCl.
2. Приготовление растворов KCl концентрации 0,01 моль/л, 0,02 моль/л, 0,1 моль/л, 0,5 моль/л.
3. Измерение электропроводности в растворах.
4. Построение графика.
Работа.
1. Чтобы приготовить 1моль/л раствор KCl я рассчитала, какое количество
сухого вещеста нужно взять на один литр. Для этого молярная масса умножается на 1моль/г.
υ·M (KCl)= M(KCl) * (υ: V) = 74,5 г/моль * 1моль/г = 74,5 г/моль
Массу сухого вещества KCl я измерила на лабораторных электронных весах, и размешала 74,5 г в 1 л воде. Получился раствор KCl концентрации 1 моль/л.
2. Нужно приготовить 0,01 молярный раствор. Этот раствор мы будем готовить в 250 мл колбе. Считаем сколько нужно взять 1 моль/л раствора KCl.
1моль/л: 0,01 моль/л = 100
Это значит, что первоначальный раствор нужно разбавить в сто раз.
250: 100 =2,5
Итак, получается, что нужно взять 2,5 мл 1 моль/л раствора KCL, довести объем до 250 мл дистиллированной водой.
Рассчитываем количество 1моль/л раствора KCl, для приготовления 0,02 моль/л, 0,1 моль/л, 0,5 моль/л растворов KCl. Ниже приведены результаты вычислений.
0,02 моль/л - 5 мл.
0,1 моль/л - 25мл
0,5моль/л - 25 мл
4. Измеряем электропроводность с помощью кондуктометра Hanna Hi 8733.
| CKCl; моль/л | 0,01 | 0,02 | 0,1 | 0,5 | 1 |
| x; мкСм/см | 1402 | 2790 | 12680 | 59100 | 112100 |
5. Построение графика в « Microsoft Office Excel 2003 ».

С увеличением концентрации, увеличивается электропроводность. Но на самом деле это не так. И на моем графике видно плавный спад увеличения электропроводности. С начала при увеличении концентрации электропроводность увеличивается, доходя до точки максиму плавно уменьшается (под редакцией д.т.н. Ельцов С.В. и др., Физическая и коллоидная химия, 2005, стр.97).Всё это связано с тем, что в неконцентрированных растворах электролитов расстояние между ионами очень большие, а сила взаимодействия между ними ничтожна мала. Следовательно, при увеличении концентрации количество ионов будет возрастать, а на скорость движения ионов это влиять не будет (что и видно на диаграмме). С дальнейшим ростом концентрации, расстояние между ионами станет настолько мало, что на ионы будет действовать сила межионного взаимодействия, что затормозит скорость ионов, следовательно приведет к уменьшению электропроводности.
Практическая работа №2.
Цель.
Доказать на практике, что в водопроводной воде содержатся примеси, которые влияют на электропроводность.
Приборы и реактивы.
1. Водопроводная вода;
2. Уксусная кислота «ледяная»;
3. Кондуктометр;
4. Мерная посуда.
План.
1. Приготовить растворы уксусной кислоты с разной концентрацией водопроводной воды.
2. Померить электропроводность приготовленных растворов.
3. Построить график.
Работа.
1. Приготовила 50%, 20%, 70% растворы уксусной кислоты. Измеряла электропроводность в пробирке объёмом 25 мл., поэтому чтобы рассчитать количество воды и уксусной кислоты для приготовления раствора нужной концентрации, 25 делила на 100 и умножала на проценты.
50% -12,5 мл;
70% - 15,5 мл;
20% - 5мл.
3. Измерение электропроводности.
| CCH3COOH ; моль/л | 100% | 70% | 50% | 20% |
| x; мкСм/см | 0,1 | 0,63 | 0,89 | 1,8 |
4. Построение графика в « Microsoft Office Excel 2003 ».
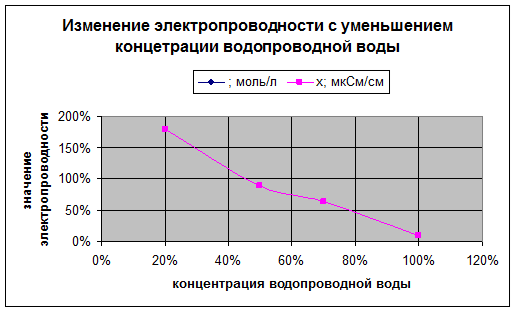
Заключение.
После проведенной работы я убедилась, что раздел физической химии – электрохимия, очень интересен.
Я собрала ряд информации по теме моего реферата и провела две практический работы, доказывающие теорию.
Список литературы и содержание ещё не написала, отправлю отдельным текстом.
 2020-01-14
2020-01-14 788
788







