Количественный анализ кинетических закономерностей топохимических реакций восстановления очень сложен. Теоретическое описание кинетики процесса восстановления для получения математической модели с перспективой внедрения ее в промышленную автоматизации разрабатывалось рядом ученых: Стальхане, Мальмберг, Любан, Манчинский и др. Наиболее полное решение было сделано Ростовцевым С.Т. в виде диффузионно-кинетической теории восстановления. При этом получились очень громоздкие уравнения, требующие для их количественного анализа ряда трудно определяемых из практики процессов параметров.
В данном разделе рассматриваются несколько идеализированных случаев восстановления, позволяющих с определенными приближениями к реальным процессам выяснить влияние ряда факторов на кинетику реакций.
Если процесс не лимитируется сложной в кинетическом описании кристаллохимической стадией зарождения новой фазы, то обратимую реакцию восстановления можно представить схемой

Скорость ее равна:  , (44)
, (44)
где  и
и  – константы скорости прямой и обратной реакций.
– константы скорости прямой и обратной реакций.
Так как общее давление газа  ,
,
то 
При равновесии  или
или 
где  – равновесное давление восстановителя.
– равновесное давление восстановителя.
Обозначив  имеем
имеем  (45)
(45)
Полученное уравнение показывает, что скорость процесса определяется величиной реакционной поверхностью, температурой и давлением газа на реакционной поверхности.
Если диффузия газа к поверхности реакционной не затруднена (кинетический режим), то  ,где
,где 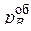 – парциальное давление газа-восстановителя в объеме реактора, и уравнение (45) принимает вид:
– парциальное давление газа-восстановителя в объеме реактора, и уравнение (45) принимает вид:
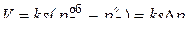 (46)
(46)
Следует отметить, что при более строгом выводе данного уравнения с учетом адсорбционно-десорбционных явлений, получаются более сложные зависимости.
Если исходный оксид состоит из частиц сферической формы с начальным радиусом  и имеет массу
и имеет массу  , то к моменту времени t произойдет изменение массы
, то к моменту времени t произойдет изменение массы  и радиуса
и радиуса 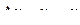 , где m и r – масса материала и радиус частиц к моменту времени t. Тогда степень восстановления α исходного оксида
, где m и r – масса материала и радиус частиц к моменту времени t. Тогда степень восстановления α исходного оксида  . Для каждой из частиц
. Для каждой из частиц  , где
, где  – плотность вещества. Подставляя m и
– плотность вещества. Подставляя m и  в выражение для
в выражение для  , получаем
, получаем

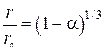 . (47)
. (47)
Скорость процесса V, выраженная через изменение количества (моль) исходного вещества в единицу времени
 (48)
(48)
где M – молярная масса вещества.
Сравнивая полученное выражение с уравнением (46) для скорости процесса в кинетическом режиме и учитывая в последнем  , получим
, получим
 и
и  . (49)
. (49)
При постоянных значениях температуры и давления, значит, k и 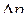 , а также молярного объема
, а также молярного объема  скорость уменьшения размера непрореагировавшей части исходного оксида постоянна, то есть
скорость уменьшения размера непрореагировавшей части исходного оксида постоянна, то есть  . После интегрирования этого уравнения от 0 до t и от
. После интегрирования этого уравнения от 0 до t и от  до r получаем
до r получаем  . Отсюда относительная толщина слоя продукта
. Отсюда относительная толщина слоя продукта
 .
.
Записав отношение размера непрореагировавшей части исходного оксида к начальному размеру через степень восстановления приходим к уравнению
 . (50)
. (50)
Это уравнение, приведенное к форме
 , (51)
, (51)
известно как закономерность модели сжимающегося объема или как уравнение Мак-Кевана. Оно предполагает быстрое образование границы раздела фаз с последующим линейным во времени продвижением реакционной зоны в объем сферического зерна.
Для полного завершении восстановления ( ) требуется время
) требуется время
 . (52)
. (52)
Оно, как видно, уменьшается с уменьшением размера частиц материала, с ростом температуры, что соответствует увеличению константы скорости, с увеличением фактического парциального давления газа-восстановителя в объеме реактора, что соответствует увеличению  .
.
Если в процессе восстановления продукт оказывается малопористым, плотным, то имеются значительные диффузионные торможения, и процесс может осуществляться в диффузионном режиме. Адсорбционно – кристаллохимические реакции идут быстро, и поэтому в порах на границе раздела фаз устанавливается давление, близкое к равновесному  , и соответствующая ему концентрация газа
, и соответствующая ему концентрация газа  .
.
На наружной поверхности частично прореагировавшего зерна устанавливается концентрация  , соответствующая давлению
, соответствующая давлению  в объеме газа при отсутствии внешнедиффузионных торможений.
в объеме газа при отсутствии внешнедиффузионных торможений.
Скорость диффузии газа через слой оксида в соответствии с законом Фика
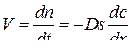 . (53)
. (53)
Для процесса со сферической формой частиц
 , (54)
, (54)
где  – радиус сферы в слое оксида, изменяющийся от
– радиус сферы в слое оксида, изменяющийся от  до r за время t.
до r за время t.
При решении этого уравнения возможны несколько различных допущений. В первом приближении для квазистационарного процесса градиент концентрации 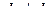 может быть заменен отношением приращений
может быть заменен отношением приращений  .
. 
Тогда  . (55)
. (55)
Введя в данное выражение скорость из выражения (48) получим
 (56)
(56)
Отсюда следует, что линейная скорость обратно пропорциональна толщине оксидного слоя. Разделим переменные и проинтегрируем
 .
.
Тогда  , (57)
, (57)
то есть толщина слоя изменяется во времени по параболическому закону  . Введя
. Введя  из выражения
из выражения  (47), получим уравнение
(47), получим уравнение
 , (58)
, (58)
которое известно как уравнение Яндера.
Оно является приближенным для частиц сферической формы, так как связь толщины слоя с радиусом непрореагировавшей части частицы малого размера оказывается более сложной.
Учет изменения объема сферы по ходу реакции может быть выполнен следующим образом. Уравнение (54) перепишем в виде  . Интегрируя в приближении независимости скорости диффузионного потока от x
. Интегрируя в приближении независимости скорости диффузионного потока от x
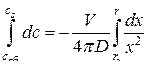 ,
,
получаем  или
или  . (59)
. (59)
Сопоставление уравнений (59) и (48) дает выражение для линейной скорости перемещения реакционной зоны
 , (60)
, (60)
из которого видна более сложная, чем из выражения (56) зависимость линейной скорости от размера r непрореагировавшей части оксида. На начальном этапе, когда 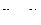 сферическая симметрия частиц не проявляется, то есть линейная скорость, как и в предыдущем случае, обратно пропорциональна толщине оксидного слоя (
сферическая симметрия частиц не проявляется, то есть линейная скорость, как и в предыдущем случае, обратно пропорциональна толщине оксидного слоя ( ). Затем при
). Затем при  с дальнейшим утолщением слоя продукта диссоциации (с уменьшением r) линейная скорость возрастает.
с дальнейшим утолщением слоя продукта диссоциации (с уменьшением r) линейная скорость возрастает.
Интегрирование уравнения (60) и введение степени превращения  через отношение (47) приводит к кинетическому уравнению
через отношение (47) приводит к кинетическому уравнению
 . (61)
. (61)
Приведенное к форме
 , (62)
, (62)
оно известно как уравнение Кранка, Гистлинга и Браунштейна.
Из уравнения (61) время полного завершения восстановления оксида ( )
)
 . (63)
. (63)
Сравнение с уравнением (52) для времени завершения процесса в кинетическом режиме приводит качественно к тем же выводам. Однако для процесса в диффузионном режиме следует отметить более сильное влияние размера зерен оксида и менее сильное влияние температуры, так как к сильному уменьшению  за счет экспоненциального роста
за счет экспоненциального роста  с ростом температуры добавляется некоторое увеличение
с ростом температуры добавляется некоторое увеличение  с ростом величины T, находящейся в числителе уравнения (63).
с ростом величины T, находящейся в числителе уравнения (63).
 2020-01-14
2020-01-14 233
233








